Victoria L Fisher, Abd A Tahrani
Victoria L Fisher
Медицинский институт при Ноттингемском университете, Ноттингем,
Abd A Tahrani
Институт метаболизма и системных исследований, Бирмингемский университет;
Отделение диабета и эндокринологии, Больница Хартлендс, Бирмингем;
Центр по изучению эндокринологии, диабета и обмена веществ, Бирмингемские госпитали-партнеры, Бирмингем, Великобритания.
Резюме: Вегетативная кардиальная нейропатия (ВКН) представляет собой распространенное и зачастую редко диагностируемое осложнение сахарного диабета (СД). Вегетативная кардиальная нейропатия у пациентов с СД ассоциируется с повышенной смертностью, сердечно-сосудистой патологией, хроническими заболеваниями почек и осложнениями, но, несмотря на эти серьезные последствия, ВКН часто остается недиагностированной в течение длительного времени. Как правило, это связано с тем, что болезнь протекает бессимптомно вплоть до поздних стадий, а также из-за отсутствия доступных стратегий скрининга. В представленной статье рассматриваются последние исследования в области эпидемиологии, патогенеза, диагностики, осложнений и методов лечения ВКН у пациентов с СД.
Ключевые слова: сердечно-сосудистый, вегетативная, нейропатия, ортостатическая гипотензия, постуральная гипотензия, гипергликемия, вариабельность сердечного ритма, симпатическая, парасимпатическая, глубокое дыхание, коэффициент Вальсальвы, коэффициент 30:15, тесты Юинга, критерии Юинга.
Введение
Сахарный диабет (СД) представляет собой глобальную эпидемию, которая, как считается, охватывает 415 миллионов человек во всем мире, при этом еще 318 миллионов человек страдают нарушением толерантности к глюкозе и подвергаются повышенному риску развития диабета [1]. Сердечно-сосудистые заболевания (ССЗ) являются основной причиной смертности и заболеваемости у пациентов с СД, значительное же влияние на заболеваемость и смертность также оказывают и связанные с диабетом микроангиопатические осложнения [2-4].
Вегетативная кардиальная нейропатия (ВКН) является распространенным недиагностированным осложнением СД [5, 6]. Вегетативная кардиальная нейропатия крайне негативно сказывается на здоровье пациентов с СД - было показано, что ВКН связана с повышенной смертностью, сердечно-сосудистой (СС) патологией, хронической болезнью почек (ХБП) и осложнениями СД [6-8]. Целью настоящей работы был анализ последних исследований, посвященных эпидемиологии, патогенезу, диагностике, осложнениям и лечению ВКН у пациентов с СД.
Поисковые стратегии
Обзор литературы выполнялся в базах данных PubMed, Google Scholar и Medline. Для поиска использовались комбинации нескольких терминов: «сердечная/кардиальная», «вегетативная», «нейропатия», «дисфункция», «кардиомиопатия», «диабет», «лечение», «диагноз», «определение», «патофизиология», «патология». Полученные результаты ограничивались исследованиями, опубликованными на английском языке в период с 2012 по 2017 годы. Также использовались ссылки на источники, указанные в этих текстах. Кроме того, мы обратились к нашему предыдущему обзору, посвященному этой теме, который был опубликован в 2014 году [9].
Эпидемиология вегетативной кардиальной нейропатии
В нескольких исследованиях изучалась распространенность ВКН у пациентов с СД 1 типа и СД 2 типа (табл. 1). В этих исследованиях были показаны значительные колебания в показателях распространенности ВКН: у 17-66 % у пациентов с СД 1 типа и у 31-73 % пациентов с СД 2 типа. Считается, что это связано с расхождениями и различиями в критериях, применяемых для диагностики ВКН, разными популяциями в исследованиях и различиями в факторах риска развития ВКН (табл. 1) [9].
Таблица 1. Обзор исследований по распространенности вегетативной кардиальной нейропатии
|
Исследование |
Диагностические пробы |
Критерии |
Предельные показатели |
Распространенность (%) |
Пациенты, n |
Тип СД |
Популяция |
Этническая принадлежность |
Примечания |
|
O’Brien с соавт. [10] |
1. Реакция ВСР на покой 2. Коэффициент E:I 3. Маневр Вальсальвы 4. Коэффициент 30:15 |
Отклонения в двух или трех пробах |
Реакция ЧСС ниже 2,5-го перцентиля (патологическая) |
17 |
506 |
СД 1 |
Средний возраст 45 лет Длительность диабета 15 лет |
Не указано |
|
|
Navarro с соавт. [11] |
1. Коэффициент E:I 3. Коэффициент Вальсальвы |
Две патологические пробы |
1. ВСР ≥15 уд/мин 2. ≥1,43 |
65,9 |
545 |
СД 1 |
Средний возраст 34 года Длительность диабета 19,4 года |
Не указано |
|
|
Chen с соавт. [12] |
1. Коэффициент E:I 2. ВСР во время 6 последовательных актов дыхания 3. Коэффициент 30:15 4. Маневр Вальсальвы 5. Падение давления в положении стоя |
3 балла и больше |
1. ВСР <8 уд/мин (1) 2. ВСР <7 уд/мин (2) 3. ВСР <17 уд/мин (1) 4. ВСР <13 уд/мин (1) 5. Падение САД >25 мм рт. ст. или падение ДАД >10 мм рт. ст. |
60,6 |
612 |
СД 2 |
Средний возраст 63,1 года Длительность диабета 10,4 года |
Данные собирались в тайваньской больнице |
В скобках указано количество баллов, которые засчитываются для каждой пробы на ССР |
|
Kempler с соавт. [13] |
1. Коэффициент 30:15 2. Падение САД в положении стоя |
Одна патологическая проба |
1. <1,04 2. Падение на >20 мм рт. ст. |
36 |
3 010 |
СД 1 |
Средний возраст 32,7 года Длительность диабета 14,7 года Средний HbA1c 6,7 % |
Данные собирались в европейских странах |
|
|
Low с соавт. [14] |
1. Тест судомоторного аксон-рефлекса 2. ВСР во время маневра Вальсальвы 3. Падение САД в положении стоя и коэффициент 30:15 4. Коэффициент E:I |
CASS ≥1 балла в двух доменах или ≥2 баллов в одном домене (судомоторный, кардиовагальный, адренергический) |
CASS – 10-балльная оценка, которая делилась на адренергическую (0-4), судомоторную (0-3) и кардиовагальную (0-3) части В документе не были указаны конкретные предельные показатели |
54 (СД 1) 73 (СД 2) |
68 (СД 1) 134 (СД 2) |
СД 1 СД 2 |
Средний возраст 59 лет HbA1c 7,4 % (СД 1) и 7,2 % (СД 2) |
СД 1 – 100 % белые СД 2 – 98 % белые |
Набирались из Рочестерского исследования по диабетической нейропатии (Rochester Diabetic Neuropathy Study); Показатель CASS был откорректирован на искажающие факторы возраста и пола |
|
Pop-Busui с соавт. [15] |
1. Коэффициент E:I 2. Маневр Вальсальвы 3. Падение ДАД в положении стоя |
Патологическая ВСР в сочетании с патологическим коэффициентом Вальсальвы или падением ДАД |
1. ВСР <15 уд/мин 2. ≤1,5 3. Падение на >10 мм рт. ст. |
29 (группа интенсивного лечения) 35 (группа стандартного лечения) |
620 (группа интенсивного лечения) 591 (группа стандартного лечения) |
СД 1 |
Средний возраст 47 лет Длительность диабета 26 лет HbA1c 7,9 % (интенсивная группа), 7,8 % (стандартная группа) |
Не указано |
Первичная медицинская помощь и вторичная (специализированная) медицинская помощь |
|
Eze с соавт. [17] |
1. ЧСС в покое 2. Коэффициент Вальсальвы 3. ВСР при глубоком дыхании 4. Коэффициент 30:15 5. Падение давления в положении стоя |
Балл ≥3 из 5 Пограничный показатель = 0,5 Патологический = 1 |
1. ≥100 уд/мин (патология) 2. ≤1,1 (патология), 1,11-1,2 (пограничный) 3. ≤10 уд/мин (патология), 11-14 уд/мин (пограничный) 4. ≤1 (патология), 1,01-1,03 (пограничный) 5. САД ≥20 мм рт. ст. (патология), ДАД ≥10 мм рт. ст. (патология) |
44,3 |
70 |
СД 2 |
Средний возраст 55,76 лет Длительность диабета 7,67 лет Мужчины 38,6 % |
Нигерийцы |
Вторичная (специализированная) медицинская помощь |
|
Tahrani с соавт. [18] |
1. Коэффициент E:I 2. Коэффициент Вальсальвы 3. Коэффициент 30:15 4. Падение давления в положении стоя |
Два и больше патологических показателя |
Показатели для определения патологии не указаны, за исключением падения САД >20 мм рт. ст. или ДАД >10 мм рт. ст. |
42,2 |
204 |
СД 2 |
Средний возраст 59,5 года Длительность диабета 15 лет Мужчины 60,5 % HbA1c 8,2 % |
Белые европеоиды – 43,6 % Южные азиаты – 56,4 % |
Вторичная (специализированная) медицинская помощь |
|
Lerner с соавт. [19] |
1. Маневр Вальсальвы 2. Падение САД в положении стоя 3. Коэффициент 30:15 4. Коэффициент E:I |
Два и больше патологических показателя |
1. <1,2 2. 10-29 мм рт. ст. (пограничный), >30 мм рт. ст. (патология) 3. <1,03 4. ВСР <10 уд./мин |
37 |
384 |
СД 2 |
Средний возраст 57,6 года |
Перу |
Первичная медицинская помощь и вторичная (специализированная) медицинская помощь |
|
Mendivil с соавт. [20] |
1. Коэффициент E:I 2. Маневр Вальсальвы 3. Коэффициент 30:15 |
Один или больше пограничных или патологических показателя |
1. ВСР ≤10 (патология), 11-14 (пограничный) 2. ≤1,1 (патология), 1,11-1,2 (пограничный) 3. ≤1 (патология), 1,01-1,03 (пограничный) |
68 |
154 |
СД 2 |
Средний возраст 61,4 года Длительность диабета 12,2 года HbA1c 7,7 % |
Латиноамери-канцы |
Вторичная (специализированная) медицинская помощь |
|
Razanskaite-Virbickiene с соавт. [21] |
1. Коэффициент E:I 2. Коэффициент 30:15 3. Падение САД в положении стоя 4. Изменения ДАД на изометрические упражнения |
Два и больше патологических показателя |
1. ≤1,1 2. ≤1,1 3. Падение на ≤20 мм рт. ст. 4. Падение на ≤10 мм рт. ст. |
32,2 |
208 |
СД 1 |
Средний возраст 20 года Длительность диабета 15,1 года HbA1c 9,46 % |
Данные собирались в литовско-швейцарском проекте |
|
|
Menon с соавт. [22] |
1. Коэффициент E:I 2. Коэффициент 30:15 3. Падение САД в положении стоя 4. Изменения ДАД на изометрические упражнения |
Один патологический показатель = возможная ВКН Два патологических показателя = достоверная ВКН |
1. 20-24 года: 1,17; 25-29: 1,15; 30-34: 1,13; 35-39: 1,12; 40-44: 1,1; 45-49: 1,08; 50-54: 1,07; 55-59: 1,06; 60-64: 1,04; 65-69: 1,03; 70-75 1,02 2. <1,03 3. Падение на >30 мм рт. ст. 4. Разница между самым высоким ДАД и ДАД в покое ≤15 мм рт. ст. |
31 (возможная) 66,2 (достоверная) |
74 |
СД 2 |
Средний возраст 61,1 года Длительность диабета 10,2 года HbA1c 8,9 % |
Не указано |
Вторичная (специализированная) медицинская помощь |
|
Tahrani с соавт. [23] |
1. Коэффициент E:I 2. Коэффициент Вальсальвы 3. Коэффициент 30:15 4. Падение САД и ДАД в положении стоя |
Два и больше патологических показателя |
Показатели для определения патологии не указаны, за исключением падения САД в положении стоя >20 мм рт. ст. или ДАД >10 мм рт. ст. |
40,9 у южных азиатов и у европеоидов |
126 (Южная Азия) 140 (европеоиды) |
СД 2 |
Средний возраст 59,2 года (европеоиды) Длительность диабета 11 лет (Южная Азия), 10,5 лет (европеоиды) HbA1c 8 % |
Европеоиды – 52,6 % Южная Азия – 47,4 % |
Вторичная (специализированная) медицинская помощь |
Примечания: ВКН – вегетативная кардиальная нейропатия; ВСР – вариабельность сердечного ритма; ДАД – диастолическое артериальное давление; САД – систолическое артериальное давление; СД – сахарный диабет; СД 1 – сахарный диабет 1 типа; СД 2 – сахарный диабет 2 типа; ССР – сердечно-сосудистый рефлекс; CASS – составная шкала тяжести вегетативной дисфункции; E:I – выдох:вдох; HbA1c– гликированный гемоглобин; ЧСС – частота сердечных сокращений.
Факторы риска развития вегетативной кардиальной нейропатии
С развитием ВКН связано несколько факторов риска, таких как гликемический контроль и продолжительность СД. Стоит отметить, что эти факторы ассоциированы и с другими осложнениями, такими как возникновение ССЗ.
Длительность диабета
Длительность диабета является основным фактором риска развития ВКН у пациентов с СД 1 и 2 типа [6, 14-16]. Заболеваемость ВКН составляет 6 % и 2 % в год у пациентов с СД 1 и 2 типа соответственно [9]. В исследовании DCCT распространенность ВКН составила 9 %, а через год после его завершения увеличилась до 31 % [24]. Подобным образом распространенность ВКН увеличилась с 19,8 % у пациентов с предиабетом до 32,2 % у пациентов с впервые диагностированным СД 2 типа [25]. При этом более высокая распространенность отмечалась именно у пациентов с СД 2 типа и при более продолжительном течении диабета [14, 26, 27]. Частота распространенности ВКН часто оказывается выше при СД 2 типа, чем СД 1 типа, несмотря на более длительную продолжительность диабета у пациентов с СД 1 типа. Это, вероятно, отражает тот факт, что СД 2 типа чаще развивается у людей более старшего возраста, у которых больше факторов СС риска развития ВКН, чем у пациентов с СД 1 типа.
Гликемический контроль
Гипергликемия играет важную роль в патогенезе связанных с диабетом микроангиопатических осложнений [28], поэтому неудивительно, что гипергликемия оказывает неблагоприятное влияние на развитие и прогрессирование ВКН. В исследовании DCCT было отмечено снижение частоты развития ВКН на 50 % в течение 6,5 лет в группе интенсивной терапии [15]. Преимущества интенсивного гликемического контроля в ходе исследования DCCT сохранялись в течение минимум 14 лет после окончания исследования, несмотря на то, что различия в показателях гликированного гемоглобина (HbА1с) между группами интенсивной и традиционной терапии исчезали после окончания рандомизации [29]. Кроме того, у участников в группе интенсивной терапии в исследовании DCCT, у которых к концу исследования не было ВКН, отмечалось снижение риска развития ВКН на 31 % по сравнению с контрольной группой (ОШ 0,69; ДИ 95 %: 0,51-0,93) [15]. В то же время, участники, у которых в конце исследования DCCT была диагностирована ВКН, демонстрировали более высокий риск развития СС осложнений в ходе последующего наблюдения, который был зависим от предыдущего гликемического воздействия или эффекта метаболической памяти [24].
|
Дополнение редакции Существуют весомые доказательства того, что дефект транспорта глюкозы вызывает приобретенную инсулинорезистентность, наблюдаемую при сахарном диабете. Это метаболическое повреждение предположительно объясняется разнообразными дефектами в регуляции GLUT 4 (тренспортер глюкозы), включая экспрессию GLUT 4 и его транслокацию, дефекты инсулинового сигнального пути и повреждение временных и пространственных характеристик сигнальных молекул. Влияние на инсулиновый сигнальный путь объясняет клиническую эффективность альфа-липоевой кислоты (АЛК) при сахарном диабете. АЛК симулирует поглощение глюкозы за счет регуляции внутренней активности транспортеров глюкозы (GLUT 1, GLUT 4). Данный эффект, по всей видимости, опосредован митогенактивированной протеин киназой (p38MAPKs). Доказано, что АЛК вызывает быстрое перераспределение GLUT 1 и GLUT 4, приводящее к стимуляции поглощения глюкозы клетками. L. Rochette et al. // Alpha-lipoic acid: molecular mechanisms and therapeutic potential in diabetes. Can. J. Physol. – 93: 1021-1027 – 2015. |
Сердечно-сосудистые факторы риска
Факторы риска развития ССЗ, такие как ожирение, курение, артериальная гипертензия и гиперлипидемия, связывают с развитием ВКН [14, 30, 31]. В исследовании EURODIAB (Европейский проект по эпидемиологии и профилактике диабета) по изучению дальнейших осложнений диабета в течение 7,3 лет изучались факторы риска развития ВКН у пациентов с СД 1 типа. Исследование показало, что систолическое артериальное давление (САД) (ОШ 1,1/10 мм рт. ст.; ДИ 95 %: 1-1,3), HbA1c (ОШ 1,2 на один процентный пункт; ДИ 95 %: 1,1-1,4) и возраст (ОШ 1,3 на десятилетие; ДИ 95 %: 1,1-1,7) значительно влияют на риск развития ВКН [31]. Поперечное исследование с участием 2230 пациентов с СД 2 типа также показало, что у пациентов с ВКН наблюдалась более высокая распространенность артериальной гипертензии, чем у пациентов без ВКН (57 % против 49 %, P<0,001) [32].
|
Дополнение редакции Экспериментальные исследования in vivo показали, что применение АЛК (перорально в течение 3 недель) вызывает уменьшение роста систолического артериального давления. Антигипертензивный эффект АЛК был связан с уменьшением оксидативного стресса в аорте и с сохранением активности глутатионпероксидазы в сыворотке крови. L. Rochette et al. // Alpha-lipoic acid: molecular mechanisms and therapeutic potential in diabetes. Can. J. Physol. – 93: 1021-1027 – 2015. Кардиопротективный эффект АЛК является результатом его антиоксидантного действия и его способности уменьшать воспаление, апоптоз и фиброз. Результатом этих эффектов является значительное увеличение уровня глутатиона (один из главных внутренних антиоксидантов) и существенное снижение повышенного уровня MDA, NO, ФНОα, Fas-L, и экспрессии гена TGFβ. Sahar K. Hegazy al. Alpha-Lipoic Acid Improves Subclinical Left Ventricular Dysfunction in Asymptomatic Patients with Type 1 Diabetes // The Review of diabetic studies 59 – Vol. 10 – No. 1 – 2013 |
Одно из исследований показало, что висцеральное ожирение ассоциировалось с развитием ВКН наряду с возрастом, постпрандиальной гликемией и диастолическим артериальным давлением (ДАД) [25]. Другое исследование у 245 пациентов с СД 1 типа и 151 пациентом с СД 2 типа показало, что ВКН независимо ассоциируется с ожирением (P=0,034) и что, в частности, при СД 2 типа, отмечается более высокая распространенность ВКН у пациентов с ожирением (P=0,033) [33]. Таким образом, можно предположить, что потеря веса способна оказывать благоприятное воздействие на ВКН [34].
|
Дополнение редакции Недавние исследования на экспериментальных нейронных моделях указывают на возможную роль AMPK (аденозинмонофосфат-активируемая протеинкиназа), выходящую за рамки функции энергетического датчика. Было обнаружено, что гипоталамический AMPK играет важную роль в центральной регуляции аппетита и расхода энергии, АЛК оказывает эффект сдерживания ожирения путем подавления гипоталамической активности АМРК. В этих условиях АЛК проявляет анорексические свойства и должна рассматриваться в качестве потенциального средства от ожирения. Marilia Brito Gomes, Carlos Antonio Negrato. Alpha-lipoic acid as a pleiotropic compound with potential therapeutic use in diabetes and other chronic diseases. Diabetology & Metabolic Syndrome - 2014.- 6: 80. Врачи из Боснии та Герцеговины, Okanović A., Prnjavorac B., Jusufović E. та Sejdinović R., провели проспективное исследование влияния альфа-липоевой кислоты на снижение массы тела и регуляцию уровня триглицеридов в сыворотке крови у пациентов с ожирением и сахарным диабетом 2 типа. Пациенты из группы наблюдения, которые принимали 600 мг/сут АЛК перорально в течение 20 недель, потеряли значительно больше веса тела, в сравнении с пациентами в контрольной группе, которые АЛК не принимали. Кроме того, 13% пациентов из группы АЛК достигли нормальных показателей индекса массы тела, тогда, как в контрольной группе этого не произошло. Пациенты из группы АЛК также имели достоверно более низкий уровень триглицеридов в сравнении с больными в контрольной группе. Okanović et al. Alpha-lipoic acid in treatment of diabetes mellitus // Medicinski Glasnik. – Volume 12, Number 2. – August 2015. |
Микроангиопатические осложнения
Микроангиопатические осложнения имеют общие механизмы, и несколько исследований показали, что микрососудистые осложнения прогнозируют развитие ВКН. Так, исследование EURODIAB продемонстрировало, что наличие ретинопатии и альбуминурии связано с риском ВКН [13]. Большое когортное исследование с участием 1021 пациента с СД 2 типа и ВКН и более чем 7,5-летним периодом наблюдения показало, что диабетическая ретинопатия (ОШ 1,513; ДИ 95 %: 1,028 -2,226, P=0,036) и более высокие уровни микроальбуминурии (ОШ 1,515; ДИ 95 %: 1,031-2,228, P=0,035) прогнозировали прогрессирование ВКН [35]. Аналогичные результаты были обнаружены в более позднем исследовании [36].
|
Дополнение редакции Экспериментальное исследование in vivo длительного перорального применения АЛК (в течение 11 месяцев) показало влияние препарата на процессы апоптоза клеток ретинальных капилляров. Процесс апоптоза является предиктором развития ретинопатии. Механизм с помощью которого АЛК ингибировала апоптоз клеток капилляров и тормозила развитие ретинопатии включает подавление оксидативного стресса и блокирование нитративного стресса в сетчатке. Длительное применение АЛК также ингибирует модифицированную оксидативным стрессом ДНК и уменьшает уровень нитротирозина (маркер оксидативного стресса) в сетчатке. Авторы исследования пришли к выводу, что применение АЛК является доступным средством, которое поможет предотвратить потерю зрения у пациентов с сахарным диабетом. Anna Gębka et al. Effect of the Administration of Alpha-Lipoic Acid on Contrast Sensitivity in Patients with Type 1 and Type 2 Diabetes. // Mediators of Клиническое исследование по оценке эффективности перорального применения АЛК в течение 3 месяцев у пациентов с сахарным диабетом 1 и 2 типа и ретинопатией показало улучшение контрастной чувствительности. Контрастная чувствительность оценивалась с помощью Functional Acuity Contrast Test. Следует отметить, что в то время, как контрастная чувствительность в группе АЛК улучшилась, в контрольной группе (не принимавшей АЛК) показатели не только не остались на прежнем уровне, а даже ухудшились. Таким образом, исследование продемонстрировало, что пероральное применение АЛК позитивно влияет на контрастную чувствительность, как у пациентов с 1 типом, так и со 2 типом сахарного диабета. Anna Gębka et al. Effect of the Administration of Alpha-Lipoic Acid on Contrast Sensitivity in Patients with Type 1 and Type 2 Diabetes. // Mediators of Inflammation – Volume 2014 – P. 7. – 2014. Открытое исследование влияния традиционной схемы применения АЛК (600 мг/сут парентерально в течение 20 дней, затем 600 мг/сут перорально – 30 дней) на течение ретинопатии у пациентов с СД (n=67) показало обнадеживающие результаты: уменьшение площади «слепого пятна» у 77 % больных, уменьшение количества кровоизлияний и отека сетчатки – у 38 %. Веселовская З., Мигаль Т., Киндий Т. Эспа-липон в лечении нарушений зрения // Диабетик. – 2001. – №2. – С. 44-45 |
Пол
Влияние пола на эпидемиологию ВКН остается спорным. Исследование ACCORD, включавшее >8000 пациентов с СД 2 типа, показало более высокую распространенность ВКН у женщин по сравнению с мужчинами при всех определениях ВКН, применявшихся в исследовании [37]. Более позднее исследование также показало, что среди женщин ВКН была распространена больше, чем среди мужчин, хотя показатели не достигали статистической значимости (65,2 % против 34,8 %, P=0,059) [38]. Однако другие исследования не показали разницы в данных распространенности ВКН между мужчинами и женщинами [13, 32, 39].
Этническое происхождение
Влияние этнической принадлежности на частоту развития ВКН также широко обсуждалось в литературе и называлось возможным фактором риска ВКН, поскольку среди южных азиатов с СД показатели периферической нейропатии (ПН) ниже, чем среди европеоидов с СД [40]. Эти сведения получили дополнительное подтверждение в недавнем исследовании, в котором белые европеоиды в два раза чаще страдали диабетической ПН (ДПН), чем южные азиаты, хотя после поправок на ожирение и рост эти показатели потеряли статистическую значимость [23]. Но, в отличие от ПН, частота развития ВКН, как было показано, не различается между этническими группами, несмотря на этнические различия в распространенности ПН [23]. Это говорит о том, что, несмотря на сходство в патогенезе ПН и вегетативной нейропатии (ВН) у пациентов с СД, существуют какие-то определенные механизмы, способные влиять на развитие одной патологии и не влиять на другую, однако этот вопрос необходимо изучать в будущем .
Патогенез вегетативной кардиальной нейропатии
Патогенез ВКН представляет собой сложный многофакторный процесс, который все еще активно обсуждается. Многие из предложенных механизмов строятся вокруг моделей поражения нейронов в силу соматической нейропатии, а не ВН. Между соматической нейропатией и ВН существует сходство, однако есть и различия, о чем свидетельствуют данные исследования STENO-2. В нем самое последнее наблюдение показало, что многофакторное вмешательство (включая интенсивную терапию или факторы риска ССЗ) может препятствовать прогрессированию ВН, тогда как влияние на соматическую нейропатию было ограниченным [41].
Гипергликемия
Гипергликемия может активировать многочисленные биохимические пути, участвующие в патогенезе ВКН. Большинство из них связано с метаболическим и/или окислительным статусом нейронных клеток. И хотя эти процессы способны самостоятельно оказать избыточное патологическое поражение, в сочетании они приводят к дисфункции митохондрий и образованию активных форм кислорода (АФК) [42]. Окислительный стресс способен индуцировать повреждение ДНК, что приводит к активации поли(АДФ-рибоза)-полимеразы и ингибированию глицеральдегид-3-фосфатдегидрогеназы [43]. Это, в свою очередь, может активировать множественные пути, включая полиоловый путь, гексозаминовый путь, а также активацию протеинкиназы С и вызывать усиленную выработку конечных продуктов усиленного гликозилирования, что, со своей стороны, прямо связано с тяжестью поражения вегетативных нервов у пациентов с СД [42, 44-47].
|
Дополнение редакции AЛК и ее редуцированная форма ДГЛК считаются мощными природными антиоксидантами со способностью захвата многих активных форм кислорода. AЛК имеет важные преимущества по сравнению с другими антиоксидантными агентами, такими как витамины Е и С, потому что ее амфифильные свойства обеспечивают антиоксидантное действие как в мембране, так и в цитоплазме клеток. AЛК также способна восстанавливать другие антиоксидантные вещества, такие как витамин С, витамин Е и соотношение редуцированного/окисленного глутатиона. Anna Gębka et al. Effect of the Administration of Alpha-Lipoic Acid on Contrast Sensitivity in Patients with Type 1 and Type 2 Diabetes. // Mediators of |
Недавние исследования подтвердили теорию о том, что гипергликемия также ухудшает регенерацию нейронов, и дали основание считать, что повышенная выработка супероксидов в плазме может прогнозировать снижение функции сердечного нерва и, в частности, может быть основным фактором, определяющим раннюю стадию развития вегетативной кардиальной дисфункции [48-50]. Что касается ВКН, предполагается, что повышенное образование АФК подавляет синаптическую передачу в вегетативных ганглиях, а это способствует повышению риска смертельных сердечных аритмий, а также внезапной смерти после инфаркта миокарда в силу посттрансляционных модификаций белка [51].
|
Дополнение редакции AЛК является мощной «ловушкой» свободных радикалов в периферических нервах, что подтверждено in vitro и in vivo . Кроме того, АЛК стимулирует выработку фактора роста нервов и усиливает регенерацию нервных волокон. У пациентов с сахарным диабетом, получавших АЛК в дозе 600 мг в/в капельно ежедневно в течение трех недель, наблюдалось уменьшение боли, парестезий и онемения, улучшалась проводимость по нервным волокнам N. Vallianou et al. Alpha-Lipoic Acid and Diabetic Neuropathy// The Review of diabetic studies - Vol. 6 - No. 4 – 2009. |
Аутоиммунитет
Вегетативная кардиальная нейропатия может развиваться в результате аутоиммунной вегетативной ганглиопатии. В этом случае вегетативная недостаточность развивается в присутствии антител к никотиновым холинорецепторам вегетативных ганглиев, что приводит к возникновению тяжелой вегетативной симптоматики, например, ортостатической неустойчивости, обморокам, запорам, гастропарезу, задержке мочи, сухости во рту, сухости в глазах, ангидрозу и к когнитивным нарушениям [52, 53]. Однако роль аутоиммунных реакций у пациентов с СД и ВКН по-прежнему остается спорной [54-57]. Недавнее небольшое поперечное исследование показало, что наличие IgG-антител связано с развитием ВН (отношение шансов 9; ДИ 95 %: 1.3-61.03) [58]. Тем не менее, до сих пор нет четкого консенсуса относительно роли аутоиммунитета в прогрессировании ВКН, а большая часть исследований, в которых была показана такая положительная связь, выполнялась с включением пациентов с СД 1 типа. Следовательно, влияют ли аутоиммуные реакции на развитие ВКН у пациентов с СД 2 типа, пока неясно [57, 59].
Генетика
Выдвинуты предположения о связи между несколькими генами и развитием и прогрессированием диабетической полинейропатии и ВКН, среди них – TCF7L2, APOE и ACE [60]. В своей работе Ciccacci и др. показали связь между однонуклеотидным полиморфизмом miRI146a и miR27a и склонностью к ВКН [61]. Однако близнецовое исследование, проведенное Osztovits и др., показало, что генетические факторы не оказывают существенного влияния на вегетативную функцию СС системы. Более того, авторы даже заявили, что факторы окружающей среды играют куда большую роль [62].
Синдром обструктивного апноэ сна
Синдром обструктивного апноэ во сне (СОАС) – распространенное явление у пациентов с СД. Считается, что это связано с ДПН у пациентов с СД 2 типа [63,64]. Хотя основным фактором риска СОАС является ожирение, Janovsky и др. показали, что СОАС может быть связан с ВКН [65]. Неопубликованные данные, полученные нашей группой, показали, что СОАС связан с ослабленным симпатическим и парасимпатическим тонусом у пациентов с СД 2 типа и что у пациентов, которые отвечали на лечение СОАС (непрерывное положительное давление в воздухоносных путях), отмечены улучшения в нескольких вегетативных параметрах в течение периода наблюдения [66, 67].
Патофизиология и взаимосвязь между СОАС и ВКН могут различаться у пациентов с СД 1 типа и 2 типа. Прерывистая гипоксия, которая возникает при СОАС, может привести к повышенной выработке АФК и нарушениям в капиллярной функции, что приводит к формированию ВКН [64]. С другой стороны, эта взаимосвязь может быть двусторонней, т. е. ВКН сама вызывает изменения в активности дыхательного центра и тонусе верхних дыхательных путей, повышая, тем самым, риск СОАС.
Воспаление
Воспаление играет важную роль в патогенезе диабета и связанных с ним микро- и макрососудистых осложнений. Вегетативная кардиальная нейропатия ассоциировалась с повышением уровня воспалительных маркеров, таких как СРБ, ИЛ-6 и ФНОα, а также с воспалением жировой ткани [47]. Однако взаимосвязь между воспалением и ВКН пока окончательно не установлена и может быть двунаправленной [47, 48]. Vinik и др. выдвинули предположение, что воспалительный ответ контролируется нейронной цепью, в которой афферентная дуга состоит из нервов, воспринимающих повреждения, и передает информацию через блуждающий нерв к стволу мозга, что, в свою очередь, активирует холинергические противовоспалительные пути, модулирующие этот самый ответ [47]. Повышенная активность передачи сигналов от блуждающего нерва к селезенке приводит к снижению ответа врожденной иммунной системы на связанные с повреждением молекулярные процессы и подавлению воспаления [47]. Следовательно, изменения в активности блуждающего нерва, вызванные ВН, могут влиять на воспалительные реакции.
|
Дополнение редакции Поскольку АЛК является скевенджером свободных радикалов, она также вызывает уменьшение воспалительной реакции за счет down-регуляции процесса сигнальной трансдукции, включающего подавление активации NF-κB. Супрессия активации NF-κB, в свою очередь, приводит к снижению уровня ФНОα и TGF-β (провоспалительные цитокины). Sahar K. Hegazy al. Alpha-Lipoic Acid Improves Subclinical Left Ventricular Dysfunction in Asymptomatic Patients with Type 1 Diabetes // The Review of diabetic studies 59 – Vol. 10 – No. 1 – 2013 Клинически релевантная дозировка АЛК ингибирует адгезию молекул экспрессии в эндотелиальных клетках аорты человека и адгезию моноцитов за счет ингибирования IκB/NF-κB сигнального пути на уровне или выше IκB киназы. АЛК ингибирует вызванную ФНОα активацию NF-κB и экспрессию молекул адгезии в эндотелиальных клетках аорты человека. Таким образом, АЛК препятствует процессу атерогенеза. Wei-Jian Zhang, Balz frei. α-Lipoic acid inhibits TNF-α-induced NF-κB activation and adhesion molecule expression in human aortic endothelial cells // The FASEB Journal – vol. 15 – no. 13 – 2001 – Р. 2423-2432 |
Диагностика и скрининг
Тесты на рефлексы вегетативной нервной системы
Тесты на рефлексы вегетативной нервной системы (ТРВС) впервые были описаны в работе Ewing и др. в 1980 году (табл. 2) [71, 100]. Подкомитет Торонтской согласительной группы по ВКН предложил определять подтвержденную ВКН при наличии по крайней мере двух отклонений в ТРВС, возможную ВКН при наличии одного отклонения в ТРВС, а также запущенную ВКН при наличии ортостатической гипотензии с двумя или более отклонениями в ТРВС [6]. Тесты на рефлексы вегетативной нервной системы считаются золотым стандартом в диагностике вегетативной функции в клинической практике, поскольку все эти тесты неинвазивны, безопасны и хорошо стандартизированы [21, 100]. И хотя ТРВС являются критериями для определения ВКН, они же применяются для оценки сердечной функции, которая может страдать у пациентов с ВКС.
Таблица 2. Обзор тестов Юинга
|
Проба на ССР |
Что она оценивает? |
Функцию какой ветви вегетативной нервной системы она измеряет? |
Интерпретация и определение |
Граничные показатели (с учетом возраста) [102] |
Диагностические результаты [101] |
|
Реакция ЧСС на глубокое дыхание (коэффициент E:I) [103, 111] |
Оценивает колебания «удар в удар» (колебания R-R) во время глубокого дыхания |
Тесты на отклонения в парасимпатической активности путем оценки способности блуждающего нерва замедлять ЧСС |
Указывается как коэффициент E:I: самый длинный интервал во время выдоха, поделенный на самый краткий интервал R-R во время вдоха |
1,22-1,1 (15-65 лет) |
S1 = 19 % S2 = 98 % P=0,115 ОШ (ДИ 95 %) = 2,34 (1,19-4,77) |
|
Реакция ЧСС на переход в положение стоя (коэффициент 30:15) [103, 111] |
Оценивает колебания «удар в удар» (колебания R-R) после перехода в положение стоя |
Тесты на отклонения в парасимпатической активности путем оценки способности блуждающего нерва замедлять ЧСС |
Указывается как коэффициент 30:15: интервал R-R в районе примерно 30-го сердечного сокращения, поделенный на интервал R-R в районе примерно 15-го сердечного сокращения |
1,17-1,06 (15-65 лет) |
S1 = 96 % S2 = 65 % P=0,001 ОШ (ДИ 95 %) = 44,07 (12,68-153,25) |
|
Маневр Вальсальвы (коэффициент Вальсальвы) [104] |
Оценивает реакцию ЧСС во время и после спровоцированного повышения внутригрудного/ внутрибрюшного давления |
Оценивает и парасимпатическую, и симпатическую активность, но преимущественно – парасимпатическую |
Указывается коэффициент Вальсальвы: самый длинный интервал R-R в фазе IV, поделенный на самый краткий интервал R-R в фазе II и в самом начале фазы III |
1,23-1,16 (15-65 лет) |
S1 = 62 % S2 = 92 % P=0,001 ОШ (ДИ 95 %) = 18,56 (5,55-62,1)
|
|
Реакция АД на переход в положение стоя (снижение САД) [103, 106, 110] |
Оценивает активность барорецепторного рефлекса |
Тесты на отклонения в симпатической активности путем оценки способности обеспечивать приемлемую реакцию ЧСС и АД на физическую активность |
Результаты теста указываются в виде разницы в САД и ДАД между положением сидя и стоя |
Снижение на 20 в САД или на 10 в ДАД |
S1 = 51 % S2 = 71 % P=0,061 ОШ (ДИ 95 %) = 2,5 (1,28-4,88) |
|
Реакция АД на длительное сокращение мышц (повышение ДАД) [103, 105] |
Повышения в ДАД, спровоцированные длительным сокращением мышц с помощью ручного динамометра |
Тесты на отклонения в симпатической активности путем оценки способности обеспечивать приемлемую реакцию ЧСС и АД на физическую активность |
Результаты теста указываются в виде разницы между самым высоким ДАД в ходе обследования и средним показателем ДАД в покое |
В норме составляет >15 мм рт. ст. |
S1 = 64 % S2 = 75 % P=0,002 ОШ (ДИ 95 %) = 5,22 (2,6-10,55) |
Примечания: Фаза I представляет собой преходящее повышение артериального давления и возникающую, как следствие, брадикардию из-за механического повышения трансторакального давления. Фаза II – сопутствующая компенсаторная тахикардия из-за уменьшения венозного оттока и ударного объема сердца, что приводит к снижению артериального давления. Фаза III – дальнейшее преходящее снижение АД и возникающая в результате тахикардия в конце акта выдыхания из-за расширения легочной сосудистой системы. Фаза IV представляет собой резкое повышение артериального давления выше исходных значений с возникающей в результате этого брадикардией, которая считается результатом барорецепторной активации. Исходя из изменений гемодинамических параметров, можно рассчитать различные показатели, в том числе коэффициент Вальсальвы, который получают по самому длинному интервалу R-R в фазе IV, поделенному на самый короткий интервал R-R в конце фазы II/начале фазы III [107]. Нормальные значения для определения граничных показателей зависят от возраста; некоторые производители программного обеспечения (например, Ansar) также указывают свои собственные нормативные значения.
S1 – чувствительность; S2 – специфичность; АД – артериальное давление; ДАД – диастолическое артериальное давление; САД – систолическое артериальное давление; ССР – сердечно-сосудистый рефлекс; ЧСС – частота сердечных сокращений; E:I – выдох:вдох.
В своей работе Pafili и др. сравнивали результаты по каждому отдельно взятому ТРВС и по их комбинации со всем набором тестов Юинга. В исследовании участвовали 152 пациента со средней продолжительностью диабета 12 лет и средним возрастом 64,51±7,85 года. Авторы сделали вывод, что коэффициент 30:15 оказался наилучшим диагностическим индикатором ВКН, при этом его чувствительность достигала 96 %, специфичность ‒ 65 %, а отрицательная прогностическая значимость ‒ 94 % и ОШ 21,14. Кроме того, было выдвинуто предположение, что если коэффициент 30:15 указывает на ВКН, то диагностическую точность можно повысить, если добавить к этому определение коэффициента Вальсальвы, критерий повышения ДАД и/или коэффициент E:I [101].
В исследовании, проведенном в сельской местности на юге Индии, 126 пациентов с СД 2 типа сравнивались со 152 здоровыми участниками в группе контроля, подобранными по возрасту и полу. Распространенность ВКН составила 53,2 % у пациентов с СД 2 типа, а вариабельность сердечного ритма (ВСР) на глубокое дыхание и ответ ДАД на изометрические упражнения оказались наиболее чувствительными тестами для выявления парасимпатической и симпатической ВН по сравнению со всеми другими ТРВС по Юингу [108]. Для диагностики парасимпатической дисфункции использовались патологические значения коэффициента Вальсальвы, ВСР на глубокое дыхание и немедленная реакция ЧСС на переход пациента в положение стоя, а для диагностики симпатической дисфункции использовались патологические показатели реакции АД на переход пациента в положение стоя и реакция АД на изометрические упражнения [108]. Другое исследование, в котором изучались пациенты с СД 1 типа в сравнении со здоровыми участниками в группе контроля, подобранными по возрасту и полу, продемонстрировало, что у пациентов с СД 1 типа показатели ВСР и восстановления ЧСС были достоверно ниже, чем в здоровом контроле, и что параметры ВСР также коррелировали с восстановлением ЧСС [109].
Спектральный анализ вариабельности сердечного ритма
Как обсуждалось выше, ВКН часто остается в субклинической форме до появления явных клинических симптомов. Субклиническая ВКН может обнаруживаться по снижению ВСР [21]. У здоровых людей наблюдаются естественные колебания «удар в удар» на вдох-выдох, которые обусловлены симпатической и парасимпатической деятельностью [9, 110]. Следовательно, отклонения в интервалах между сердечными сокращениями могут указывать на ранние изменения в вегетативной иннервации миокарда. Вариабельность сердечного ритма можно оценить с помощью анализа во временной области или частотного анализа, при этом первый вариант выполняет статистический анализ интервалов R-R (СО для всех нормальных интервалов R-R и среднеквадратическое значение разности последовательных интервалов R-R), а второй – спектральный анализ [21]. Исследования показали, что отклонения в ВСР могут присутствовать на момент диагностирования и что временной и частотный анализ могут помочь точнее оценить парасимпатическую и симпатическую активность СС системы [21, 76]. Анализ спектральной мощности ВСР может проводиться в покое с демонстрацией низкочастотных (НЧ, 0,04-0,15 Гц) и высокочастотных (ВЧ, 0,15-0,4 Гц) компонентов. НЧ-компонент спектральной мощности ВСР отражает симпатическую активность, а ВЧ-компонент (также именуемый частотой дыхательных движений [ЧДД]) в первую очередь – парасимпатическую активность. Рассчитывают соотношения НЧ:ВЧ и получают показатель симпатической/парасимпатической активности (рис. 2) [3].
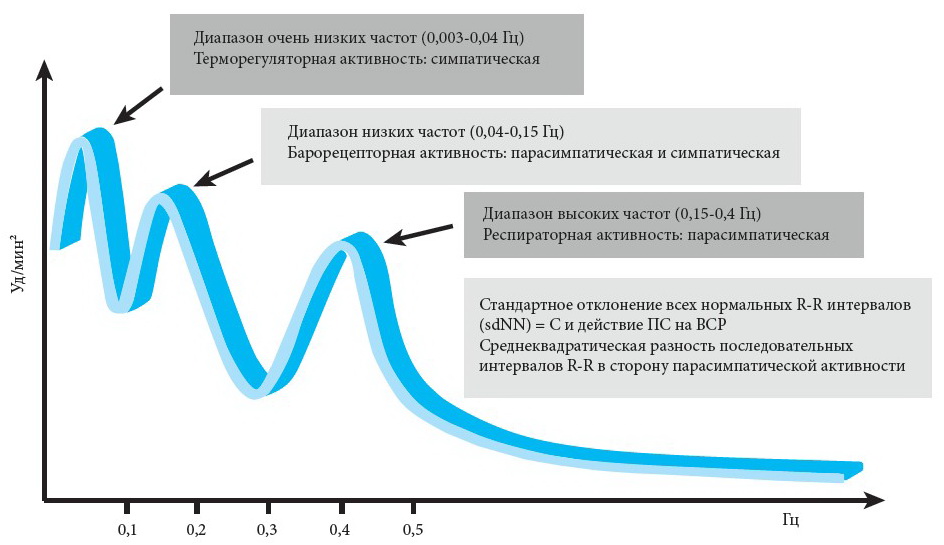
Рис. 2. Спектральный анализ вегетативной кардиальной нейропатии [47]
Примечание: ВСР – вариабельность сердечного ритма; ПС – парасимпатический; С – симпатический; sdNN – стандартные отклонения всех нормальных интервалов между «сердечными ударами».
Сцинтиграфия
Сцинтиграфия позволяет количественно оценить симпатическую сердечную иннервацию с помощью однофотонной эмиссионной компьютерной томографии и/или позитронно-эмиссионной томографии и симпатических нейротрансмиттеров, таких как 123I метаидодобенилгуанид и 11C-метагидроксиэфедрин соответственно [9, 76]. Однако эти исследования являются узкоспециализированными и дорогими, поэтому в большинстве случаев они применяются в научных исследованиях, а не в медицинской практике.
Барорефлекторная чувствительность
Повышение АД в норме улавливается барорецепторами, что вызывает рефлекторное усиление вагусной активности и снижение симпатической активности [9]. Это приводит к снижению сердечного выброса, а также к периферической вазодилатации в целях купирования повышенного АД [9]. Обратное наблюдается при снижении АД, поэтому барорефлекторная чувствительность (БРЧ) позволяет оценить как симпатическую, так и парасимпатическую активность [9].
Барорефлекторную чувствительность можно исследовать с применением фармакологических средств (например, внутривенная болюсная инъекция адреналина) или нефармакологических методов (физические маневры, например изменения положения тела) [9]. Первый вариант считается золотым стандартом на сегодняшний день для оценки БРЧ. Оба метода требуют непрерывной регистрации АД и непрерывной и синхронизированной регистрации ЧСС (интервал R-R) [9]. Кроме того, БРЧ можно оценить спонтанно, наблюдая за флуктуациями АД и интервалами R-R [111].
Использование БРЧ как метода диагностики ВКН также изучалось у пациентов с диабетом в сравнении со здоровым контролем. В своей работе Kamińska и соавт. установили, что БРЧ была значимо ниже у пациентов с СД 1 типа и ВКН, чем у пациентов без ВКН, и что БРЧ существенно не отличалась между участниками без ВКН и участниками в группе контроля, подобранными по полу и возрасту [112]. Это получило дополнительное подтверждение в исследовании, в котором было показано, что у пациентов с СД 1 типа среднее значение БРЧ, измеряемое как в мс/мм рт. ст., так и в мГц/мм рт. ст., оказывается ниже, чем у подобранных по возрасту контрольных участников (Р=0,05 и Р=0,17 соответственно) [113].
Конфокальная микроскопия роговицы
Конфокальная микроскопия роговицы (КМР) представляет собой офтальмологический метод визуализации, который может точно определять повреждение нервных волокон роговицы у пациентов с СД. Показано, что эти волокна имеют сходную структуру с тонкими вегетативными волокнами типа Aδ и С-волокнами, поэтому КМР, возможно, помогает в обнаружении ВКН [114]. В своей работе Tavakoli и соавт. установили, что КМР можно использовать для диагностики субклинической и манифестированной диабетической ВН (ДВН; на основе составной шкалы оценки вегетативной функции) [115]. У пациентов с ДВН отмечается прогрессирующее и значимое снижение плотности нервных волокон, плотности нервных ветвей и длины нервных волокон по сравнению со здоровым контролем и пациентами без ДВН. Другое исследование показало, что КМР может оказаться новым и неинвазивным инструментом для диагностики ВКН при СД 1 типа, поскольку плотность нервных волокон роговицы у пациентов с ВКН оказалась ниже, чем у пациентов без ВКН (на основе ВСР и постуральной гипотензии) [116]. Пока эта область исследований только развивается, но не исключено, что в будущем она может стать новым неинвазивным методом скрининга и диагностики ВКН.
Скрининг
Торонтская согласительная группа рекомендует проводить скрининг ВКН, поскольку его можно использовать в качестве инструмента для стратификации риска осложнений, связанных с диабетом, СС смертности и заболеваемости [6]. Американская диабетическая ассоциация также рекомендует скрининг на ВКН во время диагностирования СД 2 типа и в течение 5 лет с момента постановки диагноза СД 2 типа, особенно при наличии других осложнений [117]. Вопрос о скрининге на ВКН также целесообразно рассмотреть у пациентов с СД, которым назначена плановая операция, а также у пациентов, перенесших кардиологические события, например, после инфаркта миокарда, поскольку ВКН прогнозирует неблагоприятные исходы [3, 29].
Список литературы
- International Diabetes Federation. IDF Diabetes Atlas. 7th ed. Brussels: IDF; 2015.
- National Diabetes Information Clearinghouse. DCCT and EDIC: the Diabetes Control and Complications Trial and follow-up study. 2008. Available from: https://www.niddk.nih.gov/about-niddk/researchareas/diabetes/dcct-edic-diabetes-control-complications-trial-followup-study/Documents/DCCT-EDIC_508.pdf. Accessed July 19, 2017.
- [No authors listed]. Epidemiology of Diabetes Interventions and Complications (EDIC): design, implementation, and preliminary results of a long-term follow-up of the Diabetes Control and Complications Trial cohort. Diabetes Care. 1999;22(1):99–111.
- Domingueti CP, Dusse LM, Carvalho MG, de Sousa LP, Gomes KB, Fernandes AP. Diabetes mellitus: the linkage between oxidative stress, inflammation, hypercoagulability and vascular complications. J Diabetes Complications. 2016;30(4):738–745.
- Balcıoğlu AS, Müderrisoğlu H. Diabetes and cardiac autonomic neuropathy: clinical manifestations, cardiovascular consequences, diagnosis and treatment. World J Diabetes. 2015;6(1):80–91.
- Spallone V, Ziegler D, Freeman R, et al. Cardiovascular autonomic neuropathy in diabetes: clinical impact, assessment, diagnosis, and management. Diabetes Metab Res Rev. 2011;27(7):639–653.
- Stables CL, Glasser RL, Feldman EL. Diabetic cardiac autonomic neuropathy: insights from animal models. Auton Neurosci. 2013;177(2):74–80.
- Freeman R. Diabetic autonomic neuropathy. Handb Clin Neurol. 2014;126:63–79.
- Dimitropoulos G, Tahrani AA, Stevens MJ. Cardiac autonomic neuropathy in patients with diabetes mellitus. World J Diabetes. 2014;5(1):17–39.
- O’Brien IA, Mcfadden JP, Corrall RJ. The influence of autonomic neuropathy on mortality in insulin-dependent diabetes. Q J Med. 1991;79(290):495–502.
- Navarro X, Kennedy W, Aeppli D, Sutherland D. Neuropathy and mortality in diabetes: influence of pancreas transplantation. Muscle Nerve. 1996;19(8):1009–1016.
- Chen HS, Hwu CM, Kuo BI, et al. Abnormal cardiovascular reflex tests are predictors of mortality in type 2 diabetes mellitus. Diabet Med. 2001;18(4):268–273.
- Kempler P, Tesfaye S, Chaturvedi N, et al. Autonomic neuropathy is associated with increased cardiovascular risk factors: the EURODIAB IDDM complications study. Diabet Med. 2002;19(11):900–909.
- Low PA, Benrud-Larson LM, Sletten DM, et al. Autonomic symptoms and diabetic neuropathy: a population-based study. Diabetes Care. 2004;27(12):2942–2947.
- Pop-Busui R, Low PA, Waberski BH, et al. Effects of prior intensive insulin therapy on cardiac autonomic nervous system function in type 1 diabetes mellitus: the Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications study (DCCT/EDIC). Circulation. 2009;119(22):2886–2893.
- Pop-Busui R. Cardiac autonomic neuropathy in diabetes: a clinical perspective. Diabetes Care. 2010;33(2):434–441.
- Eze C, Onwuekwe I, Ogunniyi A. The frequency and pattern of cardiac autonomic neuropathy (CAN) in type 2 dm patients in a diabetic clinic in Enugu south-east Nigeria. Niger J Med. 2013;22(1):24–31.
- Tahrani AA, Dubb K, Raymond NT, et al. Cardiac autonomic neuropathy predicts renal function decline in patients with type 2 diabetes: a cohort study. Diabetologia. 2014;57(6):1249–1256.
- Lerner A, Bernabé-Ortiz A, Ticse R, et al. Type 2 diabetes and cardiac autonomic neuropathy screening using dynamic pupillometry. Diabet Med. 2015;32(11):1470–1478.
- Mendivil C, Kattah W, Orduz A, Tique C, Cárdenas J, Patiño J. Neuropad for the detection of cardiovascular autonomic neuropathy in patients with type 2 diabetes. J Diabetes Complications. 2016;30(1):93–98.
- Razanskaite-Virbickiene D, Danyte E, Mockeviciene G, Dobrovolskiene R, Verkauskiene R, Zalinkevicius R. Can coefficient of variation of time-domain analysis be valuable for detecting cardiovascular autonomic neuropathy in young patients with type 1 diabetes: a case control study. BMC Cardiovasc Disord. 2017;17(1):34.
- Menon AS, Dixit A, Garg MK, Girish R. Cardiac autonomic neuropathy in patients with type 2 diabetes mellitus at high risk for foot ulcers. Indian J Endocrinol Metab. 2017;21(2):282–285.
- Tahrani AA, Altaf QA, Piya MK, Barnett AH. Peripheral and autonomic neuropathy in South Asians and white Caucasians with type 2 diabetes mellitus: possible explanations for epidemiological differences. J Diabetes Res. 2017;2017:1273789.
- Pop-Busui R, Braffett BH, Zinman B, et al. Cardiovascular autonomic neuropathy and cardiovascular outcomes in the Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications (DCCT/EDIC) study. Diabetes Care. 2017;40(1):94–100.
- Dimova R, Tankova T, Guergueltcheva V, et al. Risk factors for autonomic and somatic nerve dysfunction in different stages of glucose tolerance. J Diabetes Complications. 2017;31(3):537–543.
- Pfeifer MA, Weinberg CR, Cook DL, et al. Autonomic neural dysfunction in recently diagnosed diabetic subjects. Diabetes Care. 1984;7(5):447–453.
- Ziegler D. Diabetic cardiovascular autonomic neuropathy: prognosis, diagnosis and treatment. Diabetes Metab Rev. 1994;10(4):339–383.
- Giacco F, Brownlee M. Oxidative stress and diabetic complications. Circ Res. 2010;107(9):1058–1070.
- [No authors listed]. The effect of intensive diabetes therapy on measures of autonomic nervous system function in the Diabetes Control and Complications Trial (DCCT). Diabetologia. 1998;41(4):416–423.
- Boulton AJ, Vinik AI, Arezzo JC, et al. Diabetic neuropathies: a statement by the American Diabetes Association. Diabetes Care.2005;28(4):956–962.
- Witte DR, Tesfaye S, Chaturvedi N, et al. Risk factors for cardiac autonomic neuropathy in type 1 diabetes mellitus. Diabetologia. 2005;48(1):164–171.
- Chung JO, Park SY, Cho DH, Chung DJ, Chung MY. Anemia, bilirubin, and cardiovascular autonomic neuropathy in patients with type 2 diabetes. Medicine (Baltimore). 2017;96(15):e6586.
- Valensi P, Pariès J, Attali JR. Cardiac autonomic neuropathy in diabetic patients: influence of diabetes duration, obesity, and microangiopathic complications – the French multicenter study. Metabolism. 2003;52(7):815–820.
- Maser RE, Lenhard MJ. Cardiovascular autonomic neuropathy due to diabetes mellitus: clinical manifestations, consequences, and treatment. J Clin Endocrinol Metab. 2005;90(10):5896–5903.
- Ko SH, Park SA, Cho JH, et al. Progression of cardiovascular autonomic dysfunction in patients with type 2 diabetes: a 7-year follow-up study. Diabetes Care. 2008;31(9):1832–1836.
- Huang CC, Lee JJ, Lin TK, et al. Diabetic retinopathy is strongly predictive of cardiovascular autonomic neuropathy in type 2 diabetes. J Diabetes Res. 2016;2016:6090749.
- Pop-Busui R, Evans GW, Gerstein HC, et al. Effects of cardiac autonomic dysfunction on mortality risk in the Action to Control Cardiovascular Risk in Diabetes (ACCORD) trial. Diabetes Care. 2010;33(7):1578–1584.
- Tannus LR, Drummond KR, Clemente EL, da Matta MF, Gomes MB. Predictors of cardiovascular autonomic neuropathy in patients with type 1 diabetes. Front Endocrinol (Lausanne). 2014;5:191.
- Charles M, Fleischer J, Witte DR, et al. Impact of early detection and treatment of diabetes on the 6-year prevalence of cardiac autonomic neuropathy in people with screen-detected diabetes: ADDITION-Denmark, a cluster-randomised study. Diabetologia. 2013;56(1):101–108.
- Abbott CA, Chaturvedi N, Malik RA, et al. Explanations for the lower rates of diabetic neuropathy in Indian Asians versus Europeans. Diabetes Care. 2010;33(6):1325–1330.
- Gæde P, Oellgaard J, Carstensen B, et al. Years of life gained by multifactorial intervention in patients with type 2 diabetes mellitus and microalbuminuria: 21 years follow-up on the Steno-2 randomised trial. Diabetologia. 2016;59(11):2298–2307.
- Edwards JL, Vincent AM, Cheng HT, Feldman EL. Diabetic neuropathy: mechanisms to management. Pharmacol Ther. 2008;120(1):1–34.
- Verrotti A, Prezioso G, Scattoni R, Chiarelli F. Autonomic neuropathy in diabetes mellitus. Front Endocrinol (Lausanne). 2014;5:205.
- Soriano FG, Virág L, Szabó C. Diabetic endothelial dysfunction: role of reactive oxygen and nitrogen species production and poly(ADP-ribose) polymerase activation. J Mol Med. 2001;79(8):437–448.
- Hosseini A, Abdollahi M. Diabetic neuropathy and oxidative stress: therapeutic perspectives. Oxid Med Cell Longev. 2013;2013:168039.
- Adeshara KA, Diwan AG, Tupe RS. Diabetes and complications: cellular signaling pathways, current understanding and targeted therapies. Curr Drug Targets. 2016;17(11):1309–1328.
- Vinik AI, Erbas T, Casellini CM. Diabetic cardiac autonomic neuropathy, inflammation and cardiovascular disease. J Diabetes Investig. 2013;4(1):4–18.
- Polydefkis M, Griffin JW, McArthur J. New insights into diabetic polyneuropathy. JAMA. 2003;290(10):1371–6.
- Ziegler D, Buchholz S, Sohr C, Nourooz-Zadeh J, Roden M. Oxidative stress predicts progression of peripheral and cardiac autonomic nerve dysfunction over 6 years in diabetic patients. Acta Diabetol. 2015;52(1):65–72.
- Jaiswal M, Fingerlin TE, Urbina EM, et al. Impact of glycemic control on heart rate variability in youth with type 1 diabetes: the SEARCH CVD study. Diabetes Technol Ther. 2013;15(12):977–983.
- Shah MS, Brownlee M. Molecular and cellular mechanisms of cardiovascular disorders in diabetes. Circ Res. 2016;118(11):1808–1829.
- Gibbons C, Centi J, Vernino S, Freeman R. Autoimmune autonomic ganglionopathy with reversible cognitive impairment. Arch Neurol. 2012;69(4):461–466.
- Gibbons C, Freeman R. Antibody titers predict clinical features of autoimmune autonomic ganglionopathy. Auton Neurosci. 2009;146(1–2):8–12.
- Skärstrand H, Dahlin LB, Lernmark A, Vaziri-Sani F. Neuropeptide Y autoantibodies in patients with long-term type 1 and type 2 diabetes and neuropathy. J Diabetes Complications. 2013;27(6):609–617.
- Stroud CR, Heller SR, Ward JD, Hardisty CA, Weetman AP. Analysis of antibodies against components of the autonomic nervous system in diabetes mellitus. QJM. 1997;90(9):577–585.
- Granberg V, Ejskjaer N, Peakman M, Sundkvist G. Autoantibodies to autonomic nerves associated with cardiac and peripheral autonomic neuropathy. Diabetes Care. 2005;28(8):1959–1964.
- Ejskjaer N, Arif S, Dodds W, et al. Prevalence of autoantibodies to autonomic nervous tissue structures in type 1 diabetes mellitus. Diabet Med. 1999;16(7):544–549.
- Berntorp K, Frid A, Alm R, Fredrikson GN, Sjöberg K, Ohlsson B. Antibodies against gonadotropin-releasing hormone (GnRH) in patients with diabetes mellitus is associated with lower body weight and autonomic neuropathy. BMC Res Notes. 2013;6:329.
- Zanone MM, Raviolo A, Coppo E, et al. Association of autoimmunity to autonomic nervous structures with nerve function in patients with type 1 diabetes: a 16-year prospective study. Diabetes Care. 2014;37(4): 1108–1115.
- Politi C, Ciccacci C, D’Amato C, Novelli G, Borgiani P, Spallone V. Recent advances in exploring the genetic susceptibility to diabetic neuropathy. Diabetes Res Clin Pract. 2016;120:198–208.
- Ciccacci C, Morganti R, Di Fusco D, et al. Common polymorphisms in MIR146a, MIR128a and MIR27a genes contribute to neuropathy susceptibility in type 2 diabetes. Acta Diabetol. 2014;51(4):663–671.
- Osztovits J, Horváth T, Littvay L, et al. Effects of genetic vs. environmental factors on cardiovascular autonomic function: a twin study. Diabet Med. 2011;28(10):1241–8.
- Tahrani AA. Obstructive sleep apnoea in diabetes: does it matter? Diab Vasc Dis Res. Epub 2017 Jun 1.
- Tahrani AA, Ali A, Raymond NT, et al. Obstructive sleep apnea and diabetic neuropathy: a novel association in patients with type 2 diabetes. Am J Respir Crit Care Med. 2012;186(5):434–441.
- Janovsky CC, Rolim LC, De Sá JR, et al. Cardiovascular autonomic neuropathy contributes to sleep apnea in young and lean type 1 diabetes mellitus patients. Front Endocrinol (Lausanne). 2014;5:119.
- Stevens M, Ali A, Dubb K, Begum S, Piya M, Tahrani A. Obstructive sleep apnoea is associated with cardiac autonomic abnormalities in patients with type 2 diabetes. Diabet Med. 2014;31:37. Available from: https://insights.ovid.com/diabetic-medicine/diame/2014/03/001/ obstructive-sleep-apnoea-associated-cardiac/110/00003135. Accessed September 21, 2017. Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy 2017:10 submit your manuscript | www.dovepress.com
- Altaf Q, Ali A, Tahrani A. The impact of obstructive sleep apnoea on cardiac autonomic neuropathy in patients with type 2 diabetes: a longitudinal study. 2017. Available from: http://www.neurodiab2017. com/Portals/0/Docs/abstract_book.pdf. Accessed August 31, 2017.
- Theilade S, Lyngbaek S, Hansen TW, et al. Soluble urokinase plasminogen activator receptor levels are elevated and associated with complications in patients with type 1 diabetes. J Intern Med. 2015;277(3):362–371.
- Chung T, Prasad K, Lloyd TE. Peripheral neuropathy: clinical and electrophysiological considerations. Neuroimaging Clin N Am. 2014;24(1):49–65.
- Albers JW, Pop-Busui R. Diabetic neuropathy: mechanisms, emerging treatments, and subtypes. Curr Neurol Neurosci Rep. 2014;14(8):473.
- Vinik AI, Freeman R, Erbas T. Diabetic autonomic neuropathy. Semin Neurol. 2003;23(4):365–372.
- Pop-Busui R. What do we know and we do not know about cardiovascular autonomic neuropathy in diabetes. J Cardiovasc Transl Res. 2012;5(4):463–478.
- Hillis G, Woodward M, Rodgers A, et al. Resting heart rate and the risk of death and cardiovascular complications in patients with type 2 diabetes mellitus. Diabetologia. 2012;55(5):1283–1290.
- Vinik AI, Ziegler D. Diabetic cardiovascular autonomic neuropathy. Circulation. 2007;115(3):387–397.
- [No authors listed]. Consensus statement on the definition of orthostatic hypotension, pure autonomic failure, and multiple system atrophy. Neurology. 1996;46(5):1470.
- Kuehl M, Stevens MJ. Cardiovascular autonomic neuropathies as complications of diabetes mellitus. Nat Rev Endocrinol. 2012;8(7): 405–416.
- Ninkovic VM, Ninkovic SM, Miloradovic V, et al. Prevalence and risk factors for prolonged QT interval and QT dispersion in patients with type 2 diabetes. Acta Diabetol. 2016;53(5):737–744.
- Veglio M, Chinaglia A, Cavallo-Perin P. QT interval, cardiovascular risk factors and risk of death in diabetes. J Endocrinol Invest. 2004;27(2):175–181.
- Sargin H, Ozisik M, Ozisik NC, et al. The prevalence of silent ischemia in Turkish patients with type 2 diabetes mellitus. Tohoku J Exp Med. 2005;205(4):351–355.
- Deluca AJ, Kaplan S, Aronow WS, et al. Comparison of prevalence of unrecognized myocardial infarction and of silent myocardial ischemia detected by a treadmill exercise sestamibi stress test in patients with versus without diabetes mellitus. Am J Cardiol. 2006;98(8):1045–1046.
- Wackers FJ, Young LH, Inzucchi SE, et al. Detection of silent myocardial ischemia in asymptomatic diabetic subjects: the DIAD study. Diabetes Care. 2004;27(8):1954–1961.
- Deluca AJ, Saulle LN, Aronow WS, Ravipati G, Weiss MB. Prevalence of silent myocardial ischemia in persons with diabetes mellitus or impaired glucose tolerance and association of hemoglobin A1c with prevalence of silent myocardial ischemia. Am J Cardiol. 2005;95(12):1472–1474.
- Ambepityia G, Kopelman PG, Ingram D, Swash M, Mills PG, Timmis AD. Exertional myocardial ischemia in diabetes: a quantitative analysis of anginal perceptual threshold and the influence of autonomic function. J Am Coll Cardiol. 1990;15(1):72–77.
- Valensi P, Sachs RN, Harfouche B, et al. Predictive value of cardiac autonomic neuropathy in diabetic patients with or without silent myocardial ischemia. Diabetes Care. 2001;24(2):339–343.
- Töyry JP, Niskanen LK, Länsimies EA, Partanen KP, Uusitupa MI. Autonomic neuropathy predicts the development of stroke in patients with non-insulin-dependent diabetes mellitus. Stroke. 1996;27(8):1316–1318.
- Cohen JA, Estacio RO, Lundgren RA, Esler AL, Schrier RW. Diabetic autonomic neuropathy is associated with an increased incidence of strokes. Auton Neurosci. 2003;108(1–2):73–78.
- Ko SH, Song KH, Park SA, et al. Cardiovascular autonomic dysfunction predicts acute ischaemic stroke in patients with type 2 diabetes mellitus: a 7-year follow-up study. Diabet Med. 2008;25(10):1171–1177.
- Hayat SA, Patel B, Khattar RS, Malik RA. Diabetic cardiomyopathy: mechanisms, diagnosis and treatment. Clin Sci. 2004;107(6):539–557.
- Boudina S, Abel ED. Diabetic cardiomyopathy, causes and effects. Rev Endocr Metab Disord. 2010;11(1):31–39.
- Vinik AI, Erbas T. Diabetic autonomic neuropathy. Handb Clin Neurol. 2013;117:279–294.
- Oakley I, Emond L. Diabetic cardiac autonomic neuropathy and anesthetic management: review of the literature. AANA J. 2011;79(6):473–479.
- Burgos LG, Ebert TJ, Asiddao C, et al. Increased intraoperative cardiovascular morbidity in diabetics with autonomic neuropathy. Anesthesiology. 1989;70(4):591–597.
- Latson TW, Ashmore TH, Reinhart DJ, Klein KW, Giesecke AH. Autonomic reflex dysfunction in patients presenting for elective surgery is associated with hypotension after anesthesia induction. Anesthesiology. 1994;80(2):326–337.
- Yun JS, Cha SA, Lim TS, et al. Cardiovascular autonomic dysfunction predicts diabetic foot ulcers in patients with type 2 diabetes without diabetic polyneuropathy. Medicine (Baltimore). 2016;95(12):e3128.
- Chahal S, Vohra K, Syngle A. Association of sudomotor function with peripheral artery disease in type 2 diabetes. Neurol Sci. 2017;38(1):151–156.
- Yun JS, Ahn YB, Song KH, et al. The association between abnormal heart rate variability and new onset of chronic kidney disease in patients with type 2 diabetes: a ten-year follow-up study. Diabetes Res Clin Pract. 2015;108(1):31–37.
- Forsén A, Kangro M, Sterner G, et al. A 14-year prospective study of autonomic nerve function in type 1 diabetic patients: association with nephropathy. Diabet Med. 2004;21(8):852–858.
- Maser RE, Mitchell BD, Vinik AI, Freeman R. The association between cardiovascular autonomic neuropathy and mortality in individuals with diabetes: a meta-analysis. Diabetes Care. 2003;26(6):1895–1901.
- Soedamah-Muthu SS, Chaturvedi N, Witte DR, et al. Relationship between risk factors and mortality in type 1 diabetic patients in Europe: the EURODIAB Prospective Complications Study (PCS). Diabetes Care. 2008;31(7):1360–1366.
- Pafili K, Trypsianis G, Papzoglou D, Maltezos E, Papanas N. Simplified diagnosis of cardiovascular autonomic neuropathy in type 2 diabetes using Ewing’s battery. Rev Diabet Stud. 2015;12(1–2):213–219.
- Ziegler D, Laux G, Dannehl K, et al. Assessment of cardiovascular autonomic function: age-related normal ranges and reproducibility of spectral analysis, vector analysis, and standard tests of heart rate variation and blood pressure responses. Diabet Med. 1992;9(2):166–175.
- Pfeifer MA, Cook D, Brodsky J, et al. Quantitative evaluation of cardiac parasympathetic activity in normal and diabetic man. Diabetes. 1982;31(4 Pt 1):339–345.
- Sandroni P, Benarroch EE, Low PA. Pharmacological dissection of components of the Valsalva maneuver in adrenergic failure. J Appl Physiol (1985). 1991;71(4):1563–1567.
- Ewing DJ, Campbell IW, Murray A, Neilson JM, Clarke BF. Immediate heart-rate response to standing: simple test for autonomic neuropathy in diabetes. Br Med J. 1978;1(6106):145–147.
- Borowik E, Grabowicz W, Grycewicz T, Lubiński A. Clinical usefulness of baroreflex sensitivity test in the detection of cardiovascular autonomic neuropathy in patients with type 2 diabetes mellitus. Pol Merkur Lekarski. 2015;39(233):277–280.
- Zygmunt A, Stanczyk J. Methods of evaluation of autonomic nervous system function. Arch Med Sci. 2010;6(1):11–18.
- Shrivastava S, Sukla P, Shrivastava P, Rao N. Assessment of the cardiac autonomic neuropathy among the known diabetics and age-matched controls using noninvasive cardiovascular reflex tests in a south-Indian population: a case-control study. Avicenna J Med. 2016;6(3):81–85.
- Turker Y, Aslantas Y, Aydin Y, et al. Heart rate variability and heart rate recovery in patients with type 1 diabetes mellitus. Acta Cardiol.
- Montano N, Ruscone TG, Porta A, Lombardi F, Pagani M, Malliani A. Power spectrum analysis of heart rate variability to assess the changes in sympathovagal balance during graded orthostatic tilt. Circulation. 1994;90(4):1826–1831.
- La Rovere M, Maestri R, Pinna G. Baroreflex sensitivity assessment: latest advances and strategies. Eur Cardiol. 2011;7(2):89–92.
- Kamińska A, Tafil-Klawe M, Smietanowski M, et al. Spontaneous baroreflex sensitivity in subjects with type 1 diabetes with and without cardiovascular autonomic neuropathy. Endokrynol Pol. 2008;59(5):398–402.
- Svačinová J, Honzíková N, Krtička A, Tonhajzerová I, Javorka K, Javorka M. Diagnostic significance of a mild decrease of baroreflex sensitivity with respect to heart rate in type 1 diabetes mellitus. Physiol Res. 2013;62(6):605–613.
- Messmer EM, Schmid-Tannwald C, Zapp D, Kampik A. In vivo confocal microscopy of corneal small fiber damage in diabetes mellitus. Graefes Arch Clin Exp Ophthalmol. 2010;248(9):1307–1312.
- Tavakoli M, Begum P, McLaughlin J, Malik R. Corneal confocal microscopy for the diagnosis of diabetic autonomic neuropathy. Muscle Nerve. 2015;52(3):363–370.
- Maddaloni E, Sabatino F, Del Toro R, et al. In vivo corneal confocal microscopy as a novel non-invasive tool to investigate cardiac autonomic neuropathy in type 1 diabetes. Diabet Med. 2014;32(2): 262–266.
- Buse JB, Ginsberg HN, Bakris GL, et al. Primary prevention of cardiovascular diseases in people with diabetes mellitus: a scientific statement from the American Heart Association and the American Diabetes Association. Circulation. 2007;115(1):114–126.
Опубликовано в журнале «ДОМС» №6’2017
Продолжение статьи читайте в журнале «ДОМС» №1’2018


