Амиодарон (Ам) – активно применяемый антиаритмический препарат III класса. Обладает свойствами, присущими для препаратов всех четырех классов: блокирует натриевые каналы, оказывает неконкурентное β-адреноблокирующее действие, подавляет медленные кальциевые каналы, обладает α-блокирующим эффектом. В настоящее время Ам используется для первичной профилактики желудочковых нарушений ритма и внезапной смерти, а также для поддержания синусового ритма при пароксизмальной и персистирующей форме фибрилляции предсердий, желудочковой экстрасистолии, кардиомиопатии, хронической сердечной недостаточности. Несмотря на высокую эффективность и доказанную способность влиять на отдаленный прогноз, Ам обладает значимыми побочными экстракардиальными действиями, среди которых большее значение уделяют развитию дисфункции щитовидной железы (ЩЖ), усугубляющей течение сердечно-сосудистого заболевания (ССЗ). Необходимость использования «нагрузочных» доз препарата, внутривенное введение больших доз, использование пролонгированных форм для перорального приема обуславливает значимое влияние Ам на синтез и метаболизм тиреоидных гормонов, а также инициацию патологии ЩЖ.
Этиопатогенез
Являясь жирорастворимым производным бензофурана, Ам содержит 37% йода, т.е. в одной таблетке этого препарата (200 мг) содержится 75 мг йода, структурно подобного гормонам ЩЖ, но не обладающими их свойствами. Известно, что в ходе метаболизма 200 мг Ам высвобождается 6-9 мг неорганического йода, что в 50-100 раз превышает суточную потребность организма в данном микроэлементе. Высокая липофильность, большой объем распределения приводят к накоплению препарата во многих органах и тканях, поэтому даже после прекращения приема Ам его выведение из организма занимает несколько месяцев, а концентрация йода нормализуется только спустя 6-9 мес. после отмены лекарственного средства.
Поступая в организм, Ам включается в обмен и регуляцию тиреоидных гормонов на разных уровнях: блокирует органификацию йода, способствует снижению синтеза тироксина (эффект Вольфа-Чайкова), блокирует дейодиназу 2-го типа, нарушая тем самым конверсию Т4 в Т3, блокируя захват Т4 и Т3 кардиоцитами и гепатоцитами. Все это приводит к ослаблению стимулирующего влияния тиреоидных гормонов на миокард, поэтому под влиянием Ам миокард становится более рефрактерным к эффектам этих биологически активных веществ.
Избыточное поступление йода в организм приводит к повышению йодирования тиреоглобулина и нарушению его иммуногенных свойств, что способствует развитию аутоиммунных реакций. По данным литературы, примерно у 15-20% пациентов, получавших Ам, развился тиреотоксикоз (Ам-индуцированный тиреотоксикоз, АИТ) или гипотиреоз (Ам-индуцированный гипотиреоз, АИГ). Тип дисфункции ЩЖ частично зависит от обеспеченности йодом, поскольку АИГ чаще развивается у лиц, проживающих в регионах с избыточным содержанием йода, а АИТ – с дефицитом йода. АИТ, как и АИГ, может возникнуть на любом этапе лечения Ам и даже через длительной срок после его отмены.
Рекомендации ЕТА (2018)
Диагностика, классификация и лечение Ам-ассоциированной дисфункции ЩЖ (ААДЩЖ), в частности, АИТ, часто является сложной задачей, о чем свидетельствуют данные экспертов-тиреоидологов, представленные в нескольких последних обзорах. До сих пор не установлены предикторы ААДЩЖ, а продолжающийся рост кардиологической патологии, следовательно, и увеличение назначений, потребления Ам делают проблему ААДЩЖ особенно актуальной.
Учитывая вышеперечисленные нюансы, представители Европейской тиреоидной ассоциации (European Thyrois Association, ETA) разработали практические рекомендации по лечению ААДЩЖ, основанные на данных доказательной медицины. Рабочая группа использовала градации «мы рекомендуем», указывая на сильную рекомендацию, либо «мы предлагаем» для слабых рекомендаций. Оценивалось также качество рекомендаций: Ø – очень низкое качество, ØØ – низкое, ØØØ – среднее, ØØØØ – высокое.
В рекомендациях ЕТА (2018) предложено классифицировать АИТ на два типа. АИТ 1-го типа представляет собой форму йод-индуцированного гипертиреоза, вызванную чрезмерным, неконтролированным биосинтезом тиреоидных гормонов автономно функционирующей тканью ЩЖ в ответ на избыточное поступление йода, что чаще развивается при узловом зобе, болезни Грейвса. Под АИТ 2-го типа понимают развитие деструктивного тиреоидита, возникающего, как правило, в нормальной ЩЖ. В большинстве случаев эта патология развивается в регионах с нормальным обеспечением йода и является самой распространённой формой АИТ (Таблица). Эксперты ЕТА выделяют также смешанный и неопределенный тип АИТ, при котором имеются признаки обоих форм.

Одним из камней преткновения продолжает оставаться вопрос о целесообразности продолжения приема Ам при развитии АИТ. Ответ на этот вопрос пока остается точно неопределенным в связи с отсутствием убедительной и достаточной доказательной базы как в поддержку приема Ам, так и против дальнейшего использования препарата. Эксперты рекомендуют индивидуально решать необходимость продолжения терапии Ам, учитывая мнение, как кардиологов, так и эндокринологов. Безусловно, пациентам, находящимся в критично тяжелом состоянии, прием этого антиаритмического препарата следует продолжать, но при относительно удовлетворительном состоянии сердечно-сосудистой системы позволяет (у пациентов легкой и средней степени тяжести) следует рассмотреть возможность отмены Ам.
Эксперты сформулировали несколько положений, регламентирующих лечение больных АИТ. Пациентам с АИТ 1-го типа рекомендуется назначить антитиреоидные препараты (карбимазол, метимазол, пропилтиоурацил). При этом дозы тиреостатиков несколько превышают дозировки, использующиеся для лечения диффузного токсического зоба. В случае отмены приема Ам, проводить радиойодтерапию можно после нормализации экскреции йода с мочой – через 6-12 недель. В отдельных случаях сразу назначается тиреоидэктомия.
Лечение АИТ 2-го типа отличается от такового при АИТ 1-го типа. В данном случае предусмотрено назначение преднизолона. Именно преднизолон признан наиболее эффективным для терапии АИТ 2-го типа. Начальная доза преднизолона должна составлять не менее 30 мг/сут, впоследствии предусматривается ее последующее снижение при достижении клинического и/или биохимического эутиреоза. Если АИТ приводит к ухудшению ССЗ, то требуется тиреиодэктомия.
Учитывая сложность диагностики смешанной формы АИТ, эксперты ЕТА предусматривают два подхода для ведения таких больных. Первый предполагает назначение стартовой терапии с использованием тионамидов, перхлората натрия как в случае с АИТ 1-го типа. Если на протяжении 4-6 недель данная терапия не позволила добиться значимого улучшения самочувствия, то следует добавить глюкокортикоиды (ГК). Второй подход подразумевает безотлагательную инициацию комбинированной терапии (тионамид, перхлорат натрия, ГК). Тиреоидэктомия проводится в случае неэффективности комбинированной терапии (Рисунок).
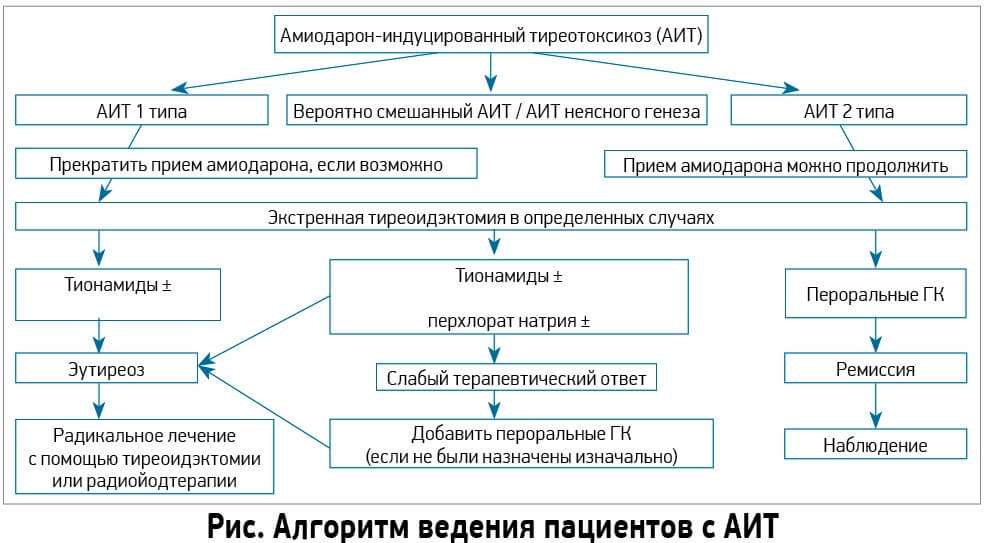
Рекомендации ЕТА (2018).
Согласно патогенетическому механизму, в тех случаях, когда показана медикаментозная терапия АИТ 1, рекомендовано применять антитиреоидные препараты (карбимазол, метимазол или пропилтиоурацил)..
Лечение АИТ 1-го типа: карбимазол предпочтительнее
Среди препаратов, рекомендованных ЕТА для лечения АИТ 1-го типа, большое внимание уделяется тионамидам и перхлорату калия. Учитывая отсутствие перхлората калия на фармацевтическом рынке Украине, отечественные эндокринологи широко используют в своей практической деятельности тионамиды (карбимазол, метимазол), действие которых обусловлено ингибированием двух стадий биосинтеза тиреоидных гормонов – органификации и конденсации. Тионамиды конкурируют с остатками тирозола в молекуле тиреоглобулина в процессе окисления йода.
В нашей стране накоплен продолжительный опыт использования тиреостатика метимазола (синоним – тиамазол) для лечения синдрома тиреотоксикоза. Однако при использовании тиамазола в клинической практике есть несколько значимых нюансов. Поступая в организм в активном виде, метимазол быстро всасывается в желудочно-кишечном тракте, кумулируется в ткани ЩЖ, где ингибирует две стадии биосинтеза тиреиодных гормонов. Такие фармакодинамические особенности обуславливают высокую вероятность развития аллергических реакций, появление тенденции к лейкопении, затрудняющих проведение тиреостатической терапии. Длительная работа над улучшением переносимости метимазола (тиамазола) привела к созданию иной молекулы – карбимазола (в Украине присутствует единственный препарат карбимазола под торговым названием ЭСПА-КАРБ, esparma GmbH, Германия). Карбимазол (ЭСПА-КАРБ) быстро и полностью всасывается в пищеварительном тракте и только после этого превращается в активную форму – тиамазол, действующую в дальнейшем уже по вышеописанному принципу. Такое поэтапное высвобождение действующего вещества непосредственно в организме более физиологично и позволяет значительно снизить риск возникновения нежелательных явлений либо полностью предотвратить их появление. Поэтому терапия карбимазолом предпочтительнее и ассоциируется с более высокой эффективностью и лучшим профилем безопасности. Применение хорошо переносимого препарата карбимазола (ЭСПА-КАРБ) позволяет назначать его длительно, успешнее завершить необходимый курс лечения и достичь клинической ремиссии гипертиреоза.
Одной из основных проблем медикаментозной терапии диффузного токсического зоба (ДТЗ) является высокая частота рецидивов заболевания после окончания лечения. В Великобритании для лечения ДТЗ в качестве тионамида применяется исключительно карбимазол. Соответственно результаты проведеного исследованиея в Великобритании частоты рецидивов ДТЗ через 2 года после окончания лечения оценивались именно после терапии карбимазолом. Пациенты принимали карбимазол в дозе 20-50 мг/сут в течение 18-ти (1-я группа) или 42-х (2-я группа) месяцев с последующим снижением дозы препарата до 5-15 мг в течение 3-х месяцев для поддержания эутиреоза. Спустя 2 года после окончания терапии карбимазолом частота рецидивов в 1-й группе составила 36%, во 2-й группе – 29%. Основываясь на полученных результатах, исследователи констатировали, что оптимальная длительность медикаментозной терапии карбимазолом больных ДТЗ составляет 18 месяцев, т.к. частота рецидивов заболевания в 1-й и 2-й группах оказалась статистически недостоверной.
Наблюдая за больными АИТ, во многом сходном с ДТЗ, необходимо большое внимание уделять вторичной и третичной профилактике – предупреждению развитию осложнений и фатального исхода, соответственно. Мероприятия вторичной профилактики предусматривают повышение осведомленности врачей и врачей и пациентов об Ам и содержащимся в нем йоде, как о факторе риска развития АИТ. При проведении терапии Ам необходимо осуществлять жесткий контроль за функциональным и структурным состоянием ЩЖ, своевременно осуществлять коррекцию тиреоидного статуса. Карбимазол (ЭСПА-КАРБ) – антитериоидный препарат, рекомендованный для лечения АИТ 1-го типа, характеризующийся высокой эффективностью и наиболее благоприятным профилем переносимости среди тионамидов.
Подготовила Гончарова О.А.
Опубликовано в медицинской газете «Здоровье Украины 21 века» №11(456)'2019


