За последние годы проблема депрессий стала одной из наиболее актуальных не только в психиатрической практике, но и в глобальном медицинском масштабе. По данным ВОЗ (не учитывающим значительное число недиагностированных маскированных, соматоформных и др. вариантов), депрессивными расстройствами различной природы страдает до 5 % населения мира, причем особенно впечатляет динамика данного показателя в течение 30 лет – с конца 1960-х гг. до конца 1990-х гг. – с 0,4 % до 5 %, т.е. более, чем в 12 раз [ 3 ]. При этом хотя бы один депрессивный эпизод в своей жизни переживают 20-25 % женщин и 7-12 % мужчин [ 6 ]. В то же время в развитых странах данный показатель существенно выше. Так, в США депрессиями страдают примерно 17 % популяции [ 25 ], а в пожилом и старческом возрасте у 35-45 % всех госпитализированных пациентов отмечаются те или иные проявления депрессивных расстройств [ 24 ]. Соответственно, исключительно велики и расходы, связанные с заболеваемостью и лечением данной патологии, что делает депрессии одним из наиболее затратных с экономической точки зрения заболеваний [ 12 ].
Существенный патоморфоз клинической картины депрессии на современном этапе, неуклонное повышение удельного веса депрессивных расстройств непсихотической природы приводит к значительному увеличению количества пациентов с депрессивными расстройствами среди больных, обращающихся к врачам первичного звена, специалистам соматического профиля – кардиологам, гастроэнтерологам и др., однако в большинстве своем – к неврологам.
Установлено, что клиническая картина депрессий наблюдается у 50-65 % пациентов, обращающихся к неврологам [ 3 ]. Депрессивные расстройства являются одними из самых распространенных осложнений инсульта. Распространенность депрессии по разным данным составляет от 5 до 63% с пиком заболеваемости через 3-6 месяцев после инсульта [ 39 ]. Среди пациентов с болезнью Паркинсона депрессивные расстройства регистрируются в 25-50% случаев в зависимости от течения заболевания [ 39 ]. Причем менее половины больных имеют классическую большую депрессию. У большинства же пациентов отмечаются умеренные формы депрессии, такие, как субсиндромальная депрессия или дистимия. Депрессия является наиболее частым сопутствующим заболеванием у пациентов, страдающих эпилепсией. Частота депрессии у пациентов с повторяющимися эпилептическими припадками достигает 20-55% [ 39 ]. Причем взаимоотношение депрессии с инсультом, болезнью Паркинсона и эпилепсией является двунаправленным. Т.е. не только депрессия встречается чаще у пациентов с перечисленными заболеваниями, но и инсульт, болезнь Паркинсона и эпилепсия чаще развиваются у больных с депрессией. Еще одним неврологическим заболеванием с беспрецедентно высоким уровнем депрессивных расстройств является рассеянный склероз. Депрессивные симптомы встречаются у 80% пациентов с данной патологией [ 39 ].
Необходимо отметить и влияние сопутствующей патологии на эмоциональный статус неврологических больных. Больные сахарным диабетом чаще других становятся пациентами врача невролога, ведь практически 28% страдают от диабетической периферической полинейропатии [ 43 ]. Причем частота неврологических осложнений достоверно выше у пациентов со вторым типом сахарного диабета [ 44 ]. В этой связи важно знать, что сахарный диабет является независимым фактором риска развития депрессии. Распространенность клинически значимой депрессии у пациентов с сахарным диабетом достигает 31% [ 41 ]. Причем у больных с хроническими заболеваниями, в частности диабетом, депрессия склонна к персистированию и рецидивированию в 11,6-92% случаев [ 42 ]. Сочетание нескольких заболеваний и депрессии может также стать причиной развития дополнительных осложнений. Так, при наличии у пациента диабета и инсульта риск развития постинсультных когнитивных нарушений повышается в два раза. Сочетание же сахарного диабета, инсульта и депрессии увеличивает этот риск в 3 раза [ 46 ]. При этом распространенность инсульта среди диабетиков в десять раз превышает показатели в общей популяции и составляет 5,5 % [ 44, 45 ]. Также на примере пациентов с сахарным диабетом наглядно можно продемонстрировать влияние депрессивной симптоматики на процесс лечения и комплаенс. Развитие депрессии приводит к увеличению риска пропуска приема медикаментов в 2,3 раза [ 41 ] и общему ухудшению комплаенса в три раза [ 47 ]. Отсутствие же приверженности пациентов диабетиков к назначенному лечению, вызванное депрессией, ухудшает контроль сахарного диабета и увеличивает риск развития неврологических осложнений. Таким образом, доля пациентов с высокой вероятностью развития депрессии на приеме у врача невролога высока. Можно сказать, что с клинической картиной депрессии встречается в своей повседневной деятельности практически каждый невролог.
Сегодня можно выделить две особенности, характеризующие депрессии в рамках неврологических расстройств. Первой является преобладание тревожного компонента в клинической картине заболевания (примерно у 77 % всех пациентов). Ко второй же относится доминирование соматовегетативной составляющей в симптоматике [ 6 ]. Важным этиологическим фактором развития упомянутых депрессий следует считать фактор психической травматизации, длительного психоэмоционального стресса, причем все большую роль приобретают социальные факторы.
В результате у таких пациентов депрессивная симптоматика наблюдается на фоне одной из форм ангионеврологической, дегенеративной патологии либо невроза (неврастении, психастении или истерии). При этом важно подчеркнуть, что в рамках упомянутой коморбидности возможно: как развитие депрессии вследствие личностной реакции пациента на имеющееся неврологическое или соматическое заболевание (соматогенная депрессия); так и соматизация первичного депрессивного расстройства в виде того или иного варианта «органного невроза», соматоформного болевого расстройства и т.д. Нередко и в том, и в другом случае характерны проявления маскированных или ларвированных депрессий, характеризующихся доминированием в клинической картине соматических, неврастенических и вегетативных симптомов, что особенно типично для депрессий при нейроциркуляторной дистонии (НЦД). При этом характерная депрессивная симптоматика выявляется в стертом виде.
Одной из наиболее распространенных «масок» современной депрессии являются алгические (болевые) синдромы с разнообразной локализацией (головные, суставные и др. боли), при которых депрессивные расстройства служат первичным патогенетическим механизмом запуска сложной нейрорефлекторной цепи с участием ноцицептивных проводящих путей и формирования «порочного круга», усугубляющего как депрессивные, так и болевые симптомы [ 1 ].
Кроме того, одной из важнейших с клинической точки зрения проблем, связанных с диагностикой и лечением депрессий в неврологической практике является значительное учащение случаев дистимии, т.е. состояний психоэмоциональной сферы, характеризующихся неустойчивостью настроения либо преобладанием сниженного психоэмоционального фона, чувством угнетенности, безразличия, которое, однако, не является стабильным, и периодически сменяется «нормальным» восприятием себя и окружения. Такие состояния, особенно характерные для различных форм неврозов [ 4, 12 ], не будучи депрессией в строгом нозологическом смысле этого термина, могут предшествовать развитию депрессивного расстройства, а могут характеризоваться стабильностью в течение весьма длительного времени.
Нужно ли корректировать депрессивную симптоматику у пациентов с неврологической патологией? В ответ на этот вопрос достаточно напомнить, что депрессивные расстройства достоверно повышают уровень смертности, инвалидизации больных, а также являются причиной стресса ухаживающих лиц и медицинского персонала, в том числе лечащего врача [ 40 ]. В этой связи знания, как клинических особенностей депрессивных проявлений, так и умения ориентироваться в спектре современных препаратов антидепрессантов и определять оптимальную стратегию лечения являются необходимостью для врача невролога.
Подход, сопровождающийся отсутствием специфической фармакотерапии упомянутых расстройств, чреват развитием впоследствии типичных депрессий, нередко с уже выраженной клинической картиной, и гораздо труднее поддающихся медикаментозному воздействию.
Вышеописанные качественные и количественные сдвиги в структуре современных депрессивных расстройств, их «невротизация» и «соматизация» в самом широком смысле этих терминов заставляют сформулировать ряд критериев для выбора соответствующего антидепрессанта - оптимального инструмента лечебной стратегии при депрессиях непсихотической природы.
К важнейшим из этих критериев следует отнести:
- Широта терапевтического спектра - эффективность при различных клинических формах депрессий;
- Наличие выраженного тимоаналептического эффекта в сочетании с анксиолитическим и/или психоэнергизирующим действием;
- Эффективное воздействие на соматическую симптоматику (вегетостабилизирующее действие);
- Безопасность (как в психофармакологическом, так и в неврологическом и соматическом плане) - минимальная частота развития побочных эффектов, отсутствие серьезных побочных эффектов;
- Отсутствие возрастных изменений фармакодинамики и фармакокинетики (возможность широкого применения в пожилом и старческом возрасте);
- Возможность применения фиксированной дозы (суточной и курсовой) или минимальная необходимость ее титрования;
- Отсутствие или ограничение риска межлекарственных взаимодействий с препаратами психо – и соматотропного типа действия;
- Возможность проведения эффективного амбулаторного лечения и максимального достижения комплайенса;
- Возможность сохранения в ходе лечения полноценных социальных функций.
Достаточная степень жесткости комплекса вышеперечисленных критериев предполагает известные сложности в выборе адекватного препарата антидепрессанта, несмотря на их широкий спектр на мировом и отечественном рынках.
Трициклические антидепрессанты (ТЦА), несмотря на всю свою эффективность, популярность и доступность, не могут рассматриваться в качестве инструмента терапии анализируемых депрессивных расстройств в силу их несоответствия подавляющему большинству упомянутых критериев, а именно для ТЦА характерны:
- Недостаточная избирательность фармакологического действия, узость терапевтического индекса (интервала между минимальной терапевтической и минимальной токсической дозами); в результате - значительное число побочных эффектов, в том числе серьезных (холинолитические, кардиотоксические, гематологические, психотические, развитие судорожного синдрома, увеличение массы тела, аллергические реакции и др.);
- Отсутствие у многих представителей ТЦА направленных вегетостабилизирующего эффекта;
- Неблагоприятное влияние на когнитивные функции;
- Необходимость титрования дозы (нередко – весьма сложного);
- Обширный потенциал межлекарственных взаимодействий (соответственно - возрастание риска побочных реакций и непрогнозируемых результатов лечения);
- Наличие значимых возрастных сдвигов в фармакодинамике и фармакокинетике (нежелательность применения в гериатрической практике);
- Сложности в организации амбулаторного лечения и достижении комплайенса;
- Наличие значительной популяции рефрактерных пациентов [ 12 ].
Хотя ТЦА могут проявлять выраженное тимоаналептическое, а в ряде случаев и мощное анксиолитическое действие, согласно современным представлениям, базирующимся на выше перечисленных критериях, ТЦА следует исключить из терапии больных депрессиями непсихотической природы, сохранив их использование только в случаях эндогенных форм под постоянным врачебным контролем. А такие пациенты, как известно, находятся за рамками неврологической практики.
Cелективные ингибиторы обратного захвата серотонина (СИОЗС) при всей своей клинической ценности также не могут рассматриваться в качестве универсального средства терапии различных форм депрессивных расстройств у всех категорий больных вследствие следующих основных причин:
- наличие определенной популяции пациентов, рефрактерных к терапии СИОЗС;
- проявление у ряда больных таких нежелательных эффектов СИОЗС как седация, нарушения сексуальной функции, в ряде случаев – более или менее выраженное холинолитическое действие, диспепсическое расстройства, нарушения сна и др.;
- достаточно высокая стоимость препаратов СИОЗС нового поколения [ 9, 12, 21 ].
В итоге, формируется весьма обширная популяция больных депрессиями в неврологической практике, у которых в силу тех или иных причин назначение препаратов СИОЗС нецелесообразно, либо недостаточно эффективно, и которым в то же время не показаны препараты ТЦА. Например, пациентам дистимией назначение «классических» антидепрессантов (и ТЦА, и СИОЗС) показаны далеко не всегда. В большей степени в данной ситуации могут быть полезны так называемые тимостабилизаторы или корректоры настроения - лекарственные средства с комплексным механизмом действия на психоэмоциональную сферу, повышающие настроение и жизненный тонус без выраженного влияния на психопатологическую симптоматику.
Исходя из вышесказанного, следует признать вполне оправданным интерес фармакологов и клиницистов к поиску и внедрению в неврологическую практику новых альтернативных препаратов антидепрессантов, не уступающих по эффективности упомянутым группам средств, но превосходящих их по критерию безопасности и, в ряде случаев, по широте терапевтического применения, при этом способных «работать» и в качестве тимостабилизатора. Повышенный интерес сейчас обращен к созданию новых антидепрессантов из растительного сырья. Внимание исследователей объясняется многими факторами. Так, препараты растительного происхождения намного лучше воспринимаются самими пациентами, они расцениваются, как более безопасные, более удобные в применении и более доступные с точки зрения цены. Кроме того, врачу намного проще убедить пациента принимать фитосредства. Как правило, многовекторное действие фитопрепаратов, которое позволяет добиться более комплексного результата, воспринимается больными, как более эффективное. Для некоторых фитопрепаратов результативность действия была подтверждена методами доказательной медицины и нашла отражение в таких значимых публикациях, как Кокрановские обзоры. Такими препаратами являются экстракты зверобоя и валерианы.
ЗВЕРОБОЙ (Hypericum perforatum) - одно из наиболее известных в мире лекарственных средств, успешно сочетающих свойства антидепрессанта и тимостабилизатора. Сегодня в Европе средства, содержащие экстракт зверобоя выписываются примерно вдвое чаще, чем препараты классических антидепрессантов [ 21 ].
Основными факторами, обуславливающими упомянутую популярность, являются комплексность механизмов действия и, соответственно, широта клинико-фармакологического спектра, позволяющая использовать препараты зверобоя при самых различных клинических формах нарушений психоэмоциональной сферы - от дистимий до выраженных депрессивных расстройств; высокая эффективность в рамках неврологических нозологических форм; благоприятные характеристики безопасности; высокая степень достижения комплайенса.
Основными алкалоидами - биологически активными веществами в составе зверобоя являются гиперицин, гиперфорин и другие флавоноиды, ксантоны и другие соединения, которые отвечают за его эффекты [ 15, 17, 32 ]. Уникальным свойством экстракта зверобоя является сочетание в его действии на ЦНС одновременно свойств ТЦА, СИОЗС и ингибиторов моноаминоксидазы (ИМАО), за счет таких механизмов, как:
- торможение активности ферментов катаболизма биогенных аминов - моноаминоксидазы (МАО), дофамин-бета-гидроксилазы и катехол-О-метилтрансферазы (КОМТ), вследствие чего, повышается активность катехоламинергической нейромедиации в ЦНС;
- блокада обратного захвата серотонина;
- модулирующее влияние на активность постсинаптических серотониновых рецепторов [ 35 ].
Благодаря такому разнонаправленному действию препараты зверобоя, в отличие от прочих антидепрессантов, влияют на все звенья синаптической регуляции моноаминергических процессов в ЦНС (синтез, обратный захват, рецепторное связывание), что позволяет рассматривать их как препараты с наиболее комплексным воздействием на катехоламин- и индоламинергические функции мозга.
Более того, экстракт зверобоя обладает дофамин- и ГАМК-ергическими свойствами, а также мембраностабилизирующими эффектами. На практике подобное разнообразие механизмов действия реализуется в исключительной широте клинико-фармакологических эффектов: собственно антидепрессивный (тимоаналептический); тимостабилизирующий; психоэнергизирующий; антиастенический; вегетостабилизирующий.
Все вышеотмеченное определяет клинические возможности экстракта зверобоя в терапии депрессий в неврологической практике, характеризующихся чрезвычайной пестротой клинических проявлений и широким диапазоном выраженности клинической симптоматики. При этом биологически активные компоненты зверобоя действуют как универсальные «модуляторы» и «стабилизаторы» нейромедиаторных процессов, играющих ведущую роль в патогенезе депрессивных расстройств.
В клинической практике применение данного средства оказалось наиболее эффективным именно при депрессиях невротического генеза легкой и умеренной степени тяжести, сопровождающихся, помимо собственно депрессивной симптоматики, общей слабостью, снижением жизненной активности, чувством переутомления и потери интереса к окружающему, потерей аппетита, инсомнией и выраженным соматовегетативным компонентом [ 10, 18, 26, 34 ]. Именно при упомянутых клинических формах депрессий в неврологической практике в максимальной степени проявляется ведущий компонент клинико-фармакологического действия данных средств: их психоэнергизирующее действие, повышение настроения и жизненной активности, работоспособности, появление чувства бодрости, улучшение концентрации внимания, значительное уменьшение астенической, тревожной и ипохондрической симптоматики, а также практически полное исчезновение соматоформных расстройств [ 22 ]. При этом препараты зверобоя одновременно являются и эффективными тимостабилизаторами у пациентов с дистимией на фоне НЦД, способствуя коррекции сниженного психоэмоционального фона и сопутствующей психовегетативной симптоматики.
Важнейшей отличительной особенностью экстракта зверобоя являются максимально ранние по сравнению с другими антидепрессантами сроки проявления тимоаналептичесокго действия - уже к концу 1-ой недели терапии, а через 2-3 недели выявляется их выраженное клиническое действие, объективно отражающееся в существенном снижении показателей шкалы Гамильтона [ 26, 37 ], что очень важно для пациентов с неврозами, в подавляющем большинстве случаев продолжающих сохранять привычный уровень социальной активности и потому особенно нетерпеливых к срокам проявления лечебного эффекта.
Важно отметить и наличие долгосрочного клинического эффекта у данных препаратов - до 6 месяцев после окончания курса лечения [ 26 ].
При сравнительном анализе клинического действия рассматриваемых средств и различных других антидепрессантов - ТЦА (имипрамин, амитриптилин, в т.ч. в сочетании с транквилизаторами), СИОЗС (пароксетин), блокаторов альфа-адренорецепторов (миансерин), четырехциклических (мапротилин) показана равноэффективность препаратов зверобоя с препаратами химической природы во влиянии на динамику различных депрессивных синдромов при лечении депрессий легкой и умеренной степени тяжести [ 22, 34, 38 ].
Наконец, еще одним принципиальным отличием экстракта зверобоя от всех без исключения антидепрессантов является то, что его прием практически не сопровождается какими-либо побочными эффектами, исключая случаи индивидуальной непереносимости [ 32, 37 ]. Исключительно благоприятные характеристики переносимости и высокая степень безопасности выгодно отличают его не только от ТЦА и ИМАО, но даже от СИОЗС, при применении которых могут возникать описанные выше побочные реакции.
Кроме того, экстракт зверобоя не образует активных метаболитов в организме, не оказывают негативного воздействия на когнитивную сферу, обладает минимальным потенциалом межлекарственного взаимодействия. Кроме того, отсутствие возрастных изменений фармакодинамики и фармакокинетики делает экстракт зверобоя особенно ценным средством для нейрогериатрической практики, где частота депрессивных расстройств традиционно высока.
Таким образом, экстракт зверобоя можно рассматривать как одно из оптимальных средств фармакотерапии депрессивных и дистимических состояний в неврологической практике, максимально полно соответствующего критериям «идеального» антидепрессанта и тимостабилизатора.
В то же время при выраженных явлениях тревожности, особенно у пациентов с неврозами или при начальных формах нарушений мозгового кровообращения возникает необходимость дополнительной коррекции упомянутых нарушений. Следует подчеркнуть, что понятие «тревожность» в данных ситуациях существенно отличается от аналогичного термина в рамках нозологических форм тревожных расстройств в психиатрической практике, и в большей степени соотносится с проявлениями беспокойства, напряженности, эмоциональной лабильности. Нередко данные проявления в гораздо большей степени нарушают социальное функционирование, чем даже собственно депрессивная симптоматика, а потому требуют обязательного фармакотерапевтического контроля.
В связи с тем, что у многих таких пациентов препараты анксиолитиков не показаны в силу их ряда побочных эффектов и сложностей в прописывании, альтернативой в рамках комплексной фитофармакотерапии могут служить седативные лекарственные средства растительной природы. К числу наиболее известных и популярных из них относится экстракт валерианы.
ВАЛЕРИАНА – одно из древнейших лекарственных средств в истории человечества. На современный этапе изучения экстракта валерианы стало точно известно, что ее эффекты определяют свыше 120 химических компонентов, среди которых важнейшими в клиническом плане являются эфирные масла, валепотриаты, аминокислоты, соли органических кислот, фенольные соединения, алкалоиды и др. [ 10, 16, 20 ]. Упомянутые соединения отвечают за многообразие клинико-фармакологических эффектов препаратов валерианы - седативного, снотворного, вегетостабилизирующего, спазмолитического, антиаритмического и т.д. [ 8, 27 ], среди которых седативное и мягкое анксиолитическое действие играют ведущую роль. В основе упомянутых эффектов лежат следующие основные механизмы:
- активация ГАМК-ергической нейромедиации (повышение высвобождения и торможение обратного захвата ГАМК, активация ГАМК-А-рецепторов) [ 14, 29, 33 ];
- стимуляция тормозных аденозиновых рецепторов [ 36 ];
- активация синтеза мелатонина [ 31 ].
Таким образом, механизмы действия валерианы на ЦНС существенно шире и многообразнее, чем многих известных нейротропных средств химической природы.
В клинических исследованиях экстракта валерианы было показано существенное снижение под его влиянием стресс-индуцированной тревожности [ 23 ], причем этот эффект был сопоставим по выраженности с эталонным анксиолитиком – диазепамом – «золотым стандартом» лечения синдрома тревоги с точки зрения мощности анксиолитического действия [ 13 ]
Особый интерес представляет возможность с помощью экстракта валерианы осуществления направленной активации синтеза мелатонина – основного регулятора циркадных ритмов и адаптационного потенциала ЦНС, что позволяет рассматривать препараты валерианы также и как универсальные адаптогены, способствующие нормализации регуляторных функций ЦНС и взаимоотношений организма с окружающей средой. Однако необходимо отметить и определенные недостатки применения монопрепаратов валерианы. Так, их прием в утренние и дневные часы может вызывать сонливость, которая затрудняет повседневную активность пациентов.
Крайне важно подчеркнуть необходимость одномоментного воздействия на депрессивную и тревожную симптоматику у пациентов неврологического профиля с целью избежания полипрагмазии и снижения рисков, возникающих при этом в результате сопутствующего назначения антидепрессантов и препаратов анксиолитиков, особенно бензодиазепинового ряда (когнитивные нарушения, привыкание и зависимость, астенизация, возможность усугубления депрессивной симптоматики и т.д.). Решить эту непростую клиническую задачу позволяет оригинальная комбинация высококонцентрированных экстрактов зверобоя и валерианы. Сочетание экстрактов ЗВЕРОБОЯ и ВАЛЕРИАНЫ в рамках одной лекарственной формы является ценным инструментом фармакотерапии тревожно-депрессивных расстройств, дистимии и нарушений психоэмоционального баланса.
Здесь уместно напомнить, что создание комбинированных лекарственных средств явилось результатом попыток оптимизации фармакотерапии неврологических заболеваний с помощью одномоментного применения двух и более химических соединений с различным механизмом действия, по-разному влияющих на патогенез и клинические проявления конкретных форм патологии.
К основным преимуществам комбинированного препарата зверобоя и валерианы следует отнести:
- Возможность применения доказанных стандартных эффективных сочетаний биологически активных веществ в рамках одной лекарственной формы (упрощение процедуры выбора лечебного средства для практического врача);
- Сокращение вынужденной полипрагмазии при сохранении или повышении (за счет синергизма клинико-фармакологических эффектов) результативности лечения;
- Улучшение комплайенса (удобство применения для больного и врача);
- Повышение экономической доступности лечения;
- Нивелирование недостатков и усиление позитивных эффектов каждого компонента (отсутствие сонливости и снижения концентрации внимания при приеме комбинации экстрактов зверобоя и валерианы в составе одного препарата).
Однако до последнего времени в Украине отсутствовали препараты, содержащие в своем составе сочетание экстрактов зверобоя и валерианы. Ситуация изменилась в связи с появлением нового для нас препарата – СЕДАРИСТОН.
Препарат СЕДАРИСТОН (Эспарма ГмбХ) был разработан немецкими фармакологами. Как известно, Германия – страна, в которой требования к доказательной медицине особенно высоки, а подход к лечению пациентов отличается рациональностью. Более того, предпочтения при выборе препаратов отдается лекарственным средствам с четко доказанным дозозависимым действием. СЕДАРИСТОН в Германии успешно применяется уже более тридцати лет, причем все эти годы внимание к нему не ослабевает. Весомая база клинических результатов применения СЕДАРИСТОНА сформировалась благодаря широкому использованию препарата, как в строго научных исследованиях, так и в повседневной врачебной практике. А многолетняя популярность СЕДАРИСТОНа является наглядным подтверждением эффективности препарата в преодолении депрессивной и тревожной симптоматики.
СЕДАРИСТОН включает в свой состав (1 капсула) сухие экстракты травы зверобоя (100 мг) и валерианы (50 мг). Следует отметить, что важной особенностью комбинированного фитопрепарата является более высокая эффективность, в отличие от применения отдельных компонентов в рамках монотерапии за счет синергизма действия их основных биологически активных компонентов. Именно это наблюдается при применении СЕДАРИСТОНа – его эффективность превышает результаты лечения монопрепаратами зверобоя с точки зрения коррекции тревожно-депрессивной симптоматики [ 28 ].
Клиническое изучение СЕДАРИСТОНа, проведенное в рамках двойных слепых, рандомизированных, плацебо-контролируемых исследованиях в европейских клиниках показало, что данный препарат обладает выраженным антидепрессивным, анксиолитическим и седативным эффектами, причем их выраженность сопоставима с эталонными препаратами антидепрессантов и анксиолитиков – амитриптилина и диазепама при лечении тревожно-депрессивных проявлений легкой и средней степени тяжести у пациентов с невротическими расстройствами, а также при дистимии [ 19, 30 ]. Было показано достоверное позитивное влияние СЕДАРИСТОНа на психовегетативную симптоматику, головную боль, боль в спине, мышечную боль, повышенную утомляемость, пассивность и др.
Здесь следует еще раз подчеркнуть, что, хотя амитриптилин и диазепам в клинической практике теперь применяются редко, в клинических исследованиях для сравнения эффектов новых лекарственных средств антидепрессивного и противотревожного ряда они по-прежнему остаются эталонными препаратами. Это объясняется выраженностью и мощностью соответственно антидепресссивного и анксиолитического действия амитриптилина и диазепама, благодаря которым они являются «золотыми стандартами» эффективности терапии. Как раз, в сравнении с этими эталонными препаратами, и проводится определение эффективности новых лекарственных средств. Кроме того, специфический профиль безопасности при приеме амитриптилина и диазепама позволяет также оценить сравниваемые препараты и с точки зрения переносимости.
Важнейшей стороной применения СЕДАРИСТОНа, особенно в сравнении с традиционными препаратами антидепрессантов (ТЦА, СИОЗС) и анксиолитиков (бензодиазепины) является его безопасность и отличная переносимость. Препарат практически не обладает какими-либо клинически значимыми побочными эффектами. Изредка наблюдающиеся головная боль, диспепсические расстройства не относятся к категории серьезных и, как правило, не требуют отмены препарата. С целью профилактики развития редко встречающейся реакции кожной фотосенсибилизации в процессе терапии СЕДАРИСТОНом рекомендуется избегать длительного пребывания на солнце.
Необходимо помнить, что эффекты СЕДАРИСТОНа определяются реакциями перестройки нейромедиаторных систем на синаптическом уровне, которые требуют времени. В связи с этим СЕДАРИСТОН – не препарат «разового» действия, хотя первые проявления антидепрессивного и седативного действия отмечаются уже на 1-ой - 2-ой неделе лечения (рисунок), для достижения долгосрочных клинически значимых эффектов более предпочтителен его курсовой прием длительностью до 4 недель, иногда - более [ 19 ]. Суточная доза составляет 4 капсулы (1х4 или 2х2) перед едой.
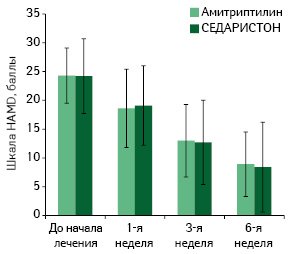
Таким образом, преимущества СЕДАРИСТОНа в лечении тревожно-депрессивных расстройств и дистимий можно сформулировать следующим образом:
- Широта клинических эффектов (влияние на депрессивную симптоматику легкой и средней степени, дистимические проявления, тревожность, нарушения сна);
- Долгосрочность клинических эффектов;
- Высокая степень достижения комплайенса (простота применения, отсутствие необходимости титрования дозы);
- Возможность безопасного применения в рамках комбинированной терапии, в пожилом и старческом возрасте;
- Минимальный риск развития побочных эффектов;
- В отличие от многих других препаратов зверобоя и валерианы на отечественном фармацевтическом рынке максимальное соответствие всем европейским стандартам качества (высокая степень очистки лекарственного сырья, современные передовые фармацевтические технологии в процессе производства).
- СЕДАРИСТОН не влияет на скорость реакции, способность к управлению автомобилем и работу со сложной техникой, что позволяет безопасно применять его самому широкому кругу пациентов без нарушения привычного ритма жизни и социальной активности.
Подводя итог, необходимо сказать, что сегодня СЕДАРИСТОН может рассматриваться как оптимальный инструмент коррекции тревожно-депрессивных расстройств и нарушений психоэмоционального баланса у самых различных категорий неврологических пациентов (цереброваскулярная патология, неврозы, НЦД, психогенные болевые синдромы и др.). Несомненно, его применение поможет безопасно и эффективно решить одну из важнейших, но далеко не решенных проблем клинической фармакотерапии в неврологической практике.
Литература
- Бурчинский С.Г. Возможности нейролептиков в фармакотерапии хронических психогенных болевых синдромов // Здоров'я України. – 2007. - № 22. – С. 61.
- Бурчинский С.Г. Депрессии в неврологической практике: проблема выбора антидепрессанта // НейроNews. – 2011. - № 4. – С. 43-45.
- Дубницкая Э.Б. Значимость правильной диагностики и лечения депрессий в общемедицинской практике // Тер. Архив. – 1997. – т.69, № 5. – С. 84-85.
- Карвасарский Б.Д. Неврозы. – М. : Медицина, 1990. – 573 с.
- Крыжановский Г.Н., Карабань И.Н., Магаева С.В., Кучеряну В.Г., Карабань Н.В. Болезнь Паркинсона. – М. : Медицина, 2002. – 335 с.
- Марута Н.А. Современные депрессивные расстройства (клинико-психопатологические особенности, диагностика, терапия) // Укр. Вісник Психоневрол. – 2001. – т.9, вип.4. – С. 79-82.
- Марута Н.А., Явдак И.А., Теренковский Д.Н. Депрессивные расстройства в структуре невротических расстройств // Укр. Вісн. Психоневрол. – 2004. – т. 12, вип. 3. – С. 81-83.
- Налетов С.В. Клиническая фармакология препаратов валерианы и европейские традиции их применения: крушение постсоветских стереотипов // Укр. Мед. Часопис. – 2009. - № 3. – С. 41-47.
- Напрєєнко О.К., Логановський К.М., Сиропятов Н.О. та ін. Нециркулярні депресії. – К.: Софія-А, 2013. – 623 с.
- Романенко В.И., Романенко Ю.И., Романенко И.В. Лечение тревожно-депрессивных расстройств в соматической практике: назначение комбинации экстрактов зверобоя и валерианы // Міжнар. Неврол. Журн. – 2016. - № 1. – С. 97-102.
- Румянцева С.А. Депрессии при хронической ишемии головного мозга у женщин // Здоров’я України. – 2005. - № 5. – С. 10.
- Смулевич А.Б. Депрессии при соматических и психических заболеваниях . – М. : МИА, 2007. – 425 с.
- Andreatini R., Sattori V.A., Seabra M.L. et al. Effect of valepotriates (valerian extract) in generalized anxiety disorder: a randomized, placebo-controlled pilot study // Phytother. – 2002. – v.16. – P. 650-654.
- Benke D., Barberis A., Kopp S. et al. GABA(A) receptors as in vivo substrate for the anxiolytic action of valerenic acid, a major constituent of valerian root extracts // Neuropharmacology. – 2009. – v.56. – P. 174-181.
- Bombardelli E., Morazzoni P. Hypericum perforatum // Fitoterapia. – 1995. – 66. – P. 43-68.
- Braun R. Valepotriates with in epoxide structure-oxygenating alcilating agents // Planta Med. – 1982. – v.41. – P. 21-28.
- Butterweck V., Schmidt M. St John’s wort: role of active compounds for its mechanism of action and efficacy // Wien Med. Wochenschr. – 2007. – v.157. – P. 356-361.
- Ernst F. St. Jonh’s wort, an antidepressant ? A systematic, criteria-based review. – Phytomedicine. – 1995. – v.2. – P. 67-71.
- Hiller K.-O., Rahifs V. Therapeutische aquivalenz eines hochdosierten phytopharmacons mit amitriptylin bei angstlich-depressiven verstimmungen – reanalyse einer randomisierten studie unter besonderer beachtung biometrischer und klinisscher aspekte // Forsch. Komplementarmed. – 1995. – Bd.2. – S. 123-132.
- Hotzl J. Valerian-Valerian officinalis // Zeit. Phytother. – 1998. – v.19. – P. 47-54.
- Josey E.S., Tackett R.L. St. John’s wort: a new alternative for depression ? // Int. J. Clin. Pharmacol. Ther. – 1999. – v. 37. – P. 111-119.
- Kasper S., Caraci F., Forti B. et al. Efficacy and tolerability of Hypericum extract for the treatment of mild to moderate depression // Eur. Neuropsychopharmacol. – 2010. – v.20. – P. 747-765.
- Kohnen R., Oswald W.D. The effect ts of valerian, propranolol, and their combination on activation, performance, and mood of healthy volunteers under social stress conditions // Pharmacopsychiatry. – 1988. – v.21. – P. 447-448.
- Kolnig H.G., Cohen H.J., Blazer D.G. et al. Profile of depressive symptoms in younger and older medical inpatients with major depression // J. Amer. Geriatr. Soc. – 1993. – v. 41. – P. 1169-1176.
- Linde K., Ramirez G., Mulrow C.D. et al. John’s wort for depression - an overview and meta-analysis of randomized clinical trials // Brit. Med. J. – 1996. – v. 313. – P. 253-258.
- Linde K., Mulrow C.D. St. John’s wort for depression (Cochrane Review) // The Cochrane Library. - - Issue 1. – Oxford : Update Software.
- Morazzoni P., Bombardelli E. Valeriana officinalis: traditional use and recent evaluation of activity // Fitoterapia. – 1994. – v.66. – P. 99-112.
- Muller D., Pfeil T., von den Driesch V. Treating depression cpmorbid with anxiety – results of an open, practice-oriented study with St. John’s wort WS 5572 and valerian extract in high doses // Phytomedicine. – 2003. – v.10, suppl. 4. – 25-30.
- Ortis J.G., Nieves-Natal J., Chavez P. Effects of Valeriana officinalis extracts on 3H-flunitrazepam binding, synaptosomal 3H-GABA uptake, and hippocampal 3H-GABA release // Neurochem. – 1999. – v.24. – P. 1373-1378.
- Panijel M. Die behandlung mittelschwerer angstzustande. Randomisierte doppelblindstudie zum klinischen wirksamkeitsvergleich eines phytotherapeutikums mit diazepam // Therapiewoche. – 1985. – Bd..41. – S. 4659-4668.
- Rodenbeck A., Simen S., Cohrs S. et al. Veranderte Schlafstadienstruktur ais Hinweis auf GABAerge Wirkung eines Baldrianhopfen-Praparates bei Patienten mit psychophysiologischer insomnie // Somnologie. – 1998. – v.2. – P. 26-31.
- Russo E., Scicchitano F., Whalley B.J. et al. Hypericum perforatum: pharmacokinetic, mechanisms of action, tolerability, and clinical drug-drug interactions // Phytother. Res. – 2014. – v.28. – P. 643-655.
- Santos M.S., Ferreira F., Cunha A.P. et al. Synaptosomal GABA release as influenced by valerian root extract – involvement of the GABA carrier // Arch. Int. Pharmacodyn. – 1994. – v.327. – P. 220-231.
- Sarris J. St John’s wort for the treatment of psychiatric disorders // Psychiatr. Clin. North Amer. – 2013. – v.36. – P. 65-72.
- Schroeder C., Tank J., Goldstein D.S. et al. Influence of St John’s wort on catecholamine turnover and cardiovascular regulation in humans // Clin. Pharmacol. Ther. – 2004. – v.76. – P. 480-489.
- Schumacher B., Scholle S., Holzl J. et Lignans isolated from valerian: identification and characterization of a new olivil derivative with partial agonistic activity at A1 adenosine receptors // J. Nat. Prod. – 2002. – v.65. – P. 1479-1485.
- Trautmann-Sponsel R.D., Dienel A. Safety of Hypericum extract in mildly to moderately depressed outpatients. A review based on data from three randomized, placebo-controlled trials // J. Affect. Disord. – 2004. – v.82. – 303-307.
- Volz H.P. Controlled clinical trial of hypericum extract in depressed patients - an overview // Pharmacopsychiatry. – 1997. – v. 30, suppl. – P. 72-76.
- Osman Sinanivic. Psychiatric disorders in neurology // Psychiatria Danubia – 2012. – v.24, suppl. 3 – P. 331-335.
- Rickardz H. Depression in neurological disorders: Parkinson’s disease, multiple sclerosis and stroke // J Neurol Neurosurg Psychiatry. – 2005. – 76, suppl. 1. – P. 48-52.
- Leonard E. Egede, Charles Ellis. Diabetes and depression: Global perspectives // Diabetes research and clinical practice. – 2010. – 87 – P. 302–312.
- Andreoulakis E. et al. Depression in diabetes mellitus: a comprehensive review // Hippokratia – 2012. – 16, 3 – P. 205-214.
- Tesfaye et al. Prevalence of diabetic peripheral neuropathy and its relation to glycaemic control and potential risk factors: the EURODIAB IDDM Complications Study // Diabetologia – 1996. – Volume 39, Issue 11. – P. 1377–1384
- Abdul Hamid Zargar et al. Profile of neurological problems in diabetes mellitus: retrospective analysis of data from 1294 patients // Health Administrator. – 2009. - Vol: XXII Number 1& 2 – P. 95-106.
- А.А. Скоромец, В.В. Ковальчук. Эпидемиология сосудистых заболеваний головного мозга // Мир Медицины. – 1998. – № 9-10.
- Swardfager W1, MacIntosh BJ2. Depression, Type 2 Diabetes, and Poststroke Cognitive Impairment. // Neurorehabil Neural Repair. – 2016 Jun 29. – pii: 1545968316656054.
- DiMatteo MR, Lepper HS, Croghan TW. Depression is a risk factor for noncompliance with medical treatment: meta-analysis of the effects of anxiety and depression on patient adherence. // Arch Intern Med. – 2000 Jul 24 - 160(14) – P. 2101-7.
Подготовил С.Г. Бурчинский
Опубликовано в журнале «Украинский медицинский журнал» №5(115)–9/10'2016


