В статье представлены результаты исследования клинической и лабораторной эффективности интермиттирующей терапии препаратом золотарника обыкновенного Цисто-аурин®, а также его влияние на качество жизни пациенток с часто рецидивирующими инфекциями мочевыводящих путей (ИМП). Получены свидетельства достоверного уменьшения числа рецидивов ИМП на 92,3% в течение 6 мес лечения препаратом. Показан положительный эффект терапии в отношении пиурии, редукция провоспалительной активности и статистически достоверное уменьшение проявлений воспаления в мочевой системе. Редукция лейкоцитурии составила 73,4%. Выявлен клинически значимый и статистически достоверный бактериостатический эффект как в
процессе лечения (на 41,0%), так и в 6-месячный период наблюдения (на 30,3%), антибактериальный эффект в отношении клинически значимых уропатогенов, достоверное уменьшение выраженности ключевых клинических симптомокомплексов рецидивирующих ИМП, достоверное улучшение показателей качества жизни пациенток.
Актуальность проблемы
Воспалительные процессы инфекционной природы в различных отделах мочевыделительной системы, а именно инфекции мочевыводящих путей (ИМП), относятся к наиболее социально-значимым и финансово-затратным инфекционным заболеваниям человека. В структуре инфекционной заболеваемости они занимают второе место, уступая лишь респираторным инфекциям [1]. Также они лидируют по формированию резистентных формы микроорганизмов вследствие антибактериальной терапии. Распространенность ИМП, склонность к частому рецидивированию, рост резистентности возбудителей ИМП к действию антибиотиков определяют тот факт, что более 15% всех амбулаторно назначаемых в США антибиотиков выписываются по поводу ИМП. Известно, что 45-72% от общего числа женщин как минимум один раз в жизни сталкивается с эпизодом острого цистита, при этом часто-рецидивирующие ИМП (3 и более эпизода за год) наблюдаются у 20-27% этих пациенток [4, 5]. Часто-рецидивирующие ИМП крайне негативно влияют на качество жизни больных, вызывая значительное снижение самооценки, дезадаптацию и социальную изоляцию, что часто требует привлечения специалистов-психологов, психиатров и невропатологов.
Уникальными особенностями этой патологии являются присутствие «тихих» микробных резервуаров инвазивных штаммов уропатогенной E.Coli в субэпителиальном слое мочевого пузыря, колонизация бактериями подлежащих слоев уротелия, образование биопленок и интраэпителиальная бактериальная аккумуляция латентных форм резистентных уропатогенов [6-10].
Ядром современной стратегии лечения часто-рецидивирующих ИМП является антибактериальная терапия и антибиотикопрофилактика [5, 9-11]. Между тем, ежегодный прирост резистентности уропатогенов на фоне стагнации разработок новых антибактериальных субстанций за последние десятилетия, негативные проявления антибиотикотерапии в виде иммуносупрессии, грибковой инфекции, кишечного и генитального дисбиоза, диктуют целесообразность и эффективность разработки альтернативных подходов без использования антибиотикотерапии [10-12]. Перспективным и многообещающим является применение традиционных средств лечения, в частности, фитотерапевтических препаратов на основе экстрактов лекарственных растений, таких, как золотарник обыкновенный. Среди прочих средств он выделяется широким спектром терапевтических эффектов, известной антибактериальной и противовоспалительной активностью в отношении уропатогенов.
Среди активных веществ Solidago virgaurea – органические и фенолкарболовые кислоты, сапонины и флавоноиды, в т.ч. рутин, кверцетин, кверцитрин и другие, определяющие основной диапазон фармакологических эффектов золотарника [13-17].
Золотарник – традиционное средство лечения инфекционно-воспалительной патологии мочевой системы, применяемое при инфекциях мочевых путей на протяжении более 500 лет [15]. На сегодняшний день изучены антибактериальные, спазмолитические, десенсибилизирующие и мочегонные эффекты растения, опубликованы результаты мультицентровых исследований и обзоров применения Solidago virgaurea [13-15]. Популярности золотарник достиг в средние века благодаря своим анальгетическим свойствам, способности ускорять заживление ран и использованию для лечения воспаления мочевого пузыря. Фармакопейное применение растения при патологии мочеполовой системы рекомендовано рядом профессиональных ассоциаций и комиссий в качестве диуретического, противовоспалительного и спазмолитического средства [15-16].
Ряд экспертов полагают, что противовоспалительные свойства золотарника – это результат действия лейокарпозида, фенольного гликозида листьев и стеблей растения [18-20]. Результаты экспериментального исследования экстракта растения, проведенного учеными Каирского университета, показали противовоспалительную активность, сопоставимую с диклофенаком натрия [19,20,29-31]. Работами последних лет показано ингибирование провоспалительного энзима, - лейкоцитарной эластазы под действием экстрактов золотарника, а также потенцирование синтеза и выброса в кровяное русло глюкокортикоидов, модулирующих реакции воспаления [21,31]. Экстракты Solidago virgaurea тормозят связывание брадикинина с брадикининовыми рецепторами, что является отражением аналгезирующей активности золотарника [23-25,33]. Экспериментально показано, что обезболивающее действие лейокарпозида, по-видимому, основного аналгезирующего компонента экстракта, сопоставимо с активностью аминофеназона (амидопирина) [33]. Экстракты растения in vitro тормозят активность ксантиноксидазы и других систем, отвечающих за перекисное окисление липидов, проявляя тем самым антиоксидантную активность [26-28]. Изучена и спазмолитическая активность экстракта золотарника, сопоставимая с таковой папаверина. In vitro определена способность золотарника расслаблять гладкую мускулатуру мочевого пузыря, связанная с неконкурентной блокадой М2 и М3-холинорецепторов [29-31].
Значительным количеством исследователей изучены антибактериальные свойства Solidago virgaurea. Работами Bratner A. [35], а также Thiem B. et al [36] выявлена активность экстракта растения в отношении грампозитивных и грамнегативных микроорганизмов, включая возбудителей ИМП семейства Enterobacteriacea и клинически-значимых штаммов Proteus mirabilis и Pseudomonas aeruginosa. Кроме того, выявлена активность в отношении грибов рода Candida, в том числе биопленок, связанных с персистенцией этого инфекционного агента [19-25]. В исследованиях Strehl E. et al [37] показана способность экстракта растения к ингибированию дигидрофолатредуктазы – энзима, определяющего деление бактериальных клеток, а также указано на возможность прямого повреждения бактериальных клеточных стенок и их лизиса [22, 15]. В зависимости от степени бактериальной колонизации, вирулентности возбудителя и дозировки, экстракты Solidago virgaurea проявляют бактериостатический или бактерицидный эффект, однако точный механизм действия остается невыясненным [18-21].
Выраженность мочегонного эффекта золотарника в исследовании Dietmar Schakau [38] была продемонстрирована увеличением объема отделяемой мочи на 27% по сравнению с плацебо. Особенность акваретической активности растения состоит в увеличении диуреза без потенцирования выделения с мочой ионов натрия, хлора, калия и бикарбоната, что позволяет длительно принимать экстракт с мочегонной целью без риска электролитных нарушений. Акваретический эффект, наряду с антибактериальной и противовоспалительной активностью экстракта растения во многом определяют уроселективный характер его действия [34].
Противорецидивные свойства золотарника для профилактики рекуррентных ИМП изучены в исследованиях Emanuela Frumenzio et al.[39]. Пациентки с частыми рецидивами ИМП (n=164), были разделены на две группы. Группе А (n=57) назначен профилактический прием антибиотика (в частности, фосфомицина 1 саше 1 раз/неделю на протяжении 3 месяцев). Женщинам группы В (n=107) дополнительно к антибиотику назначали фитопрепарат, основным компонентом которого был золотарник. По истечению 3 месяцев частота рецидивов инфекций мочевыводящих путей достоверно не отличалась между группами: 11,21% в группе комбинированной терапии и 10,52% в группе изолированной антибиотикопрофилактики (р=0,854). Однако спустя 12 месяцев после окончания профилактической терапии картина значительно изменилась: женщины группы В, принимавшие золотарник, в 2,5 раза реже сталкивались с рецидивами ИМП в отличие от участниц группы А, получавших антибиотик в качестве монотерапии (р<0,0001). Исследователи подчеркнули, что в долгосрочной перспективе прием золотарника характеризовался значительным уменьшением количества эпизодов ИМП, а также удлинением времени до развития рецидива, что значительно улучшило качество жизни пациенток.
Благодаря специфической высокой активности в отношении органов мочеполовой системы, Solidago virgaurea в форме экстракта уже более 20 лет выпускается в коммерчески-доступных медицинских препаратах, показания к применению которых преимущественно направлены на ИМП и МКБ [13-14]. Единственный стандартизованный препарат золотарника в дозировке 300мг (препарат ЦИСТО-АУРИН) представлен в Украине немецкой компанией esparma GmbH, Aristo group.
Целью нашего исследования стало повышение эффективности лечения и улучшение качества жизни больных часто-рецидивирующими инфекциями мочевыводящей системы посредством интермиттирующего приема препарата Цисто-аурин (Solidago virgaurea).
Материалы и методы
Для реализации цели нами на базе урологической клиники Одесского национального медицинского университета, городской клинической больницы №10 г. Одесса и медицинского центра «Новые медицинские технологии», проведено открытое проспективное контролируемое исследование эффективности и переносимости оригинального препарата золотарника обыкновенного Цисто-аурин, представляющего собой сухой экстракт травы золотарника, в 1 таблетке которого содержится 300мг стандартизованного экстракта Solidago virgaurea.
62 пациентки с хроническим рецидивирующим циститом (средний возраст 42 года) были включены в исследование. Критерием включения послужили характерные клинические проявления, наличие трех и более эпизодов обострения цистита на протяжении года (EAU Guidelines, 2017), отсутствие серьезной сопутствующей патологии. В период обострения больные предъявляли жалобы на учащенное, болезненное мочеиспускание малыми порциями, императивные позывы, тупые боли над лоном вне акта мочеиспускания, выделение мутной мочи. На этапе включения в исследование все больные имели лабораторные проявления бактериурии различной выраженности.
Больные были разделены на две, статистически однородные по возрасту и спектру основных клинических проявлений группы: основная клиническая, n=32 (группа А), а также группа сравнения, n=30 (группа В) (см. табл.1). Согласно действующему руководству по инфекции в урологии (EAU Guidelines on urological infections, 2017), в ходе лечения пациентки всех групп использовали стратегию поведенческой терапии (не передерживать мочеиспускание, соблюдать тщательную гигиену, ограничить употребление острой и экстрактивной пищи) и посткоитальной профилактики (раннее мочеиспускание и гигиенические процедуры после коитуса). Пациентки клинической группы А прошли курс лечения - интермиттирующий прием препарата Цисто-аурин по 1 табл. 4р в день курсами по 15 дней каждого месяца в течение 6 месяцев. В силу выраженных антибактериальных свойств препарата Цисто-аурин антибиотик не применялся. Пациентки группы В (группы сравнения) никакой специальной терапии не получали. Проспективный период наблюдения составил 6 месяцев после окончания приема исследуемого препарата.
Табл.1. Характеристика исследуемых групп до начала лечения
|
Показатель |
группа А |
группа В |
|
|
Число включенных/завершивших исследование больных (n) |
32/30 |
30/30 |
|
|
Возраст, лет |
41.83±5.46 |
42.84±5,53 |
|
|
Число эпизодов острого цистита за предыдущие 12 мес |
4.77±0.58 |
4.83±0.68 |
|
|
Данные культурального исследования мочи |
Наличие моноинфекции в бакпосеве |
26.7% |
33.3% |
|
E.Coli |
43.3% |
36.7% |
|
|
Proteus spp. |
10.0% |
13.8% |
|
|
Klebsiella spp. |
23.3% |
20.0% |
|
|
Candida spp. |
23.3% |
26.7% |
|
Для инициальной диагностики в том числе использовали заполнение стандартизированных шкал оценки качества жизни, связанного со здоровьем SF-36 и шкал оценки симптомов заболевания Urinary Tract Infection Symptom Assessment (UTISA).
Оценка эффективности лечения проводилась на протяжении года, с контрольными визитами через 15 дней, 3, 6, 9 и 12 месяцев от начала исследования. Критериями эффективности послужили частота рецидивных эпизодов цистита в проспективный период наблюдения, оценка качества жизни, связанного со здоровьем по SF-36 в динамике, оценка влияния лечения на выраженность симптомов UTISA с детализацией динамики частоты, характера и эффективности мочеиспусканий, а также динамика лабораторных показателей пиурии и бактериурии.
Результаты
В ходе исследования получены результаты лечения пациенток клинической группы А, а также больных группы сравнения В. Пациентки, получающие исследуемый препарат, в целом удовлетворительно переносили назначенное лечение. Клинически-значимых негативных проявлений терапии, которые бы повлекли за собой отмену либо коррекцию лечения, выявлено не было. Общий опрос пациенток до и после курса лечения показал, что позитивный клинический эффект терапии отмечен у 86,7% больных группы А, и только у 20% больных группы сравнения В. Помимо субъективной удовлетворенности результатами лечения, получены статистически достоверные и клинически значимые данные позитивной динамики лабораторных показателей пиурии и бактериурии, частоты и характера мочеиспусканий, частоты и длительности рецидивов ИМП и динамики качества жизни по ключевым параметрам на фоне приема препарата Цисто-аурин. По всем оценочным критериям объективной, лабораторной и клинической эффективности, получены подтверждения более высокой результативности лечения как в течение приема препарата, так и в 6-месячный проспективный период наблюдения, по сравнению с больными группы В.
При оценке объективных показателей результатов лечения, одним из ключевых маркеров стало наличие рецидивных эпизодов ИМП у исследуемых больных. Эффективность приема препарата была достоверно выше среди больных группы А, где снижение количества рецидивов цистита в течении первых 3 месяцев лечения составило 69,2%, а в течении 6 месяцев – 92,3% (см. рис.1). Аналогичные показатели группы сравнения В составили 21,4% и 7,1%, соответственно. Анализ динамики среднего числа рецидивов в клинической группе выявил статистически достоверные изменения по отношению к исходным данным, как на протяжении лечения, так и в проспективный период. В группе А было зафиксировано 4 рецидива ИМП в первые 3 месяца и всего 1 рецидив в период 3й-6й месяц лечения, в то время как в группе сравнения В количество рецидивов составило 11 и 13 эпизодов, сответственно.
Рис.1. Число рецидивных эпизодов ИМП (за предыдущие 3 месяца) в динамике.

Абсолютное большинство больных не имело высоких показателей пиурии на момент начала исследования. Мы категоризировали результаты исследований средней порции мочи в группы условной нормы (0-5 нейтрофилов в поле зрения), низкой и высокой пиурии (6-10 и 11-30 нейтрофилов, соответственно). Обработка данных лейкоцитурии у пациенток клинической группы показала достоверное снижение данного показателя уже через 15 дней приема препарата (см. рис.2): на 33,9%, с дальнейшей градиентной регрессией в ходе лечения на 73,4%, т.е. в 3,7 раза ниже исходного значения. Интересно, что и при отмене препарата, в проспективный период наблюдения, лейкоцитурия сохранялась ниже базовых показателей на 49,2%. В то же время, среди больных группы сравнения статистически-значимой динамики как во время лечения, так и впоследствии, выявлено не было.
Рис.2. Динамика лейкоцитурии у больных клинических групп. (Желтая линия – условная выраженная патология, зеленая линия – условная норма).
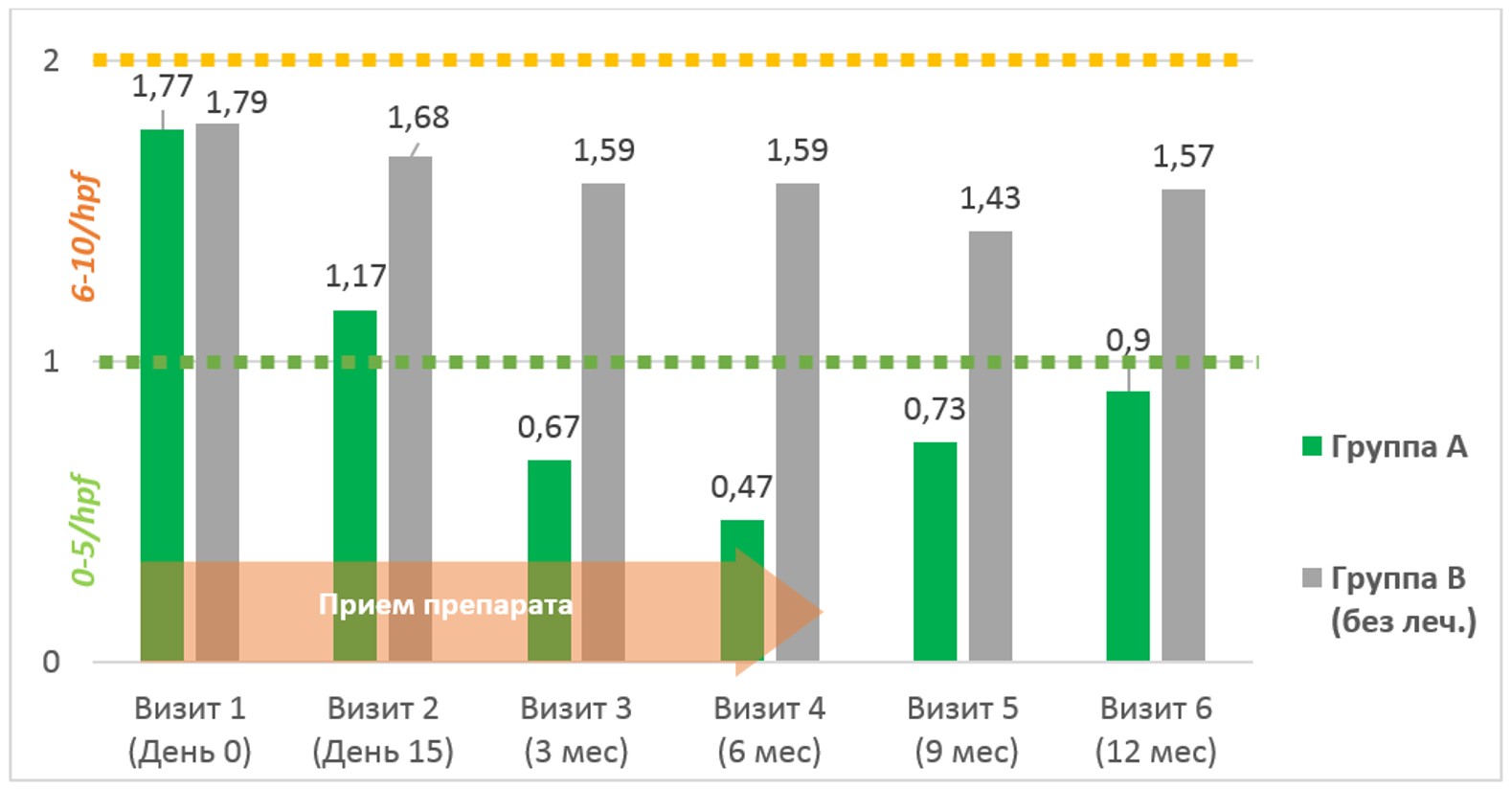
Оценка количественных данных и структуры бактериурии – важнейшее объективное мерило как статического профиля клинической когорты пациенток, так и эффективности лечения. В отличие от больных с острым циститом, пациентки с часто-рецидивирующей ИМП имеют существенно бὀльший полиморфизм выявленных уропатогенов, частое сочетанием двух и более в культуральных исследованиях, значимо меньший процент выявляемых культур E.Coli, прирост штаммов Klebsiella spp., Proteus spp, а также Candida spp. (см.табл.1) Отмечено достоверное снижение показателя степени бактериурии на протяжении лечения у больных основной группы – на 41,0%, а на протяжении всего 12-месячного периода наблюдений – на 30,3% (см. рис.3). Динамика бактериурии у группы сравнения клинически значимых отклонений не выявила.
Рис.3. Степень бактериурии у исследуемых больных в динамике, КОЕ (10n)
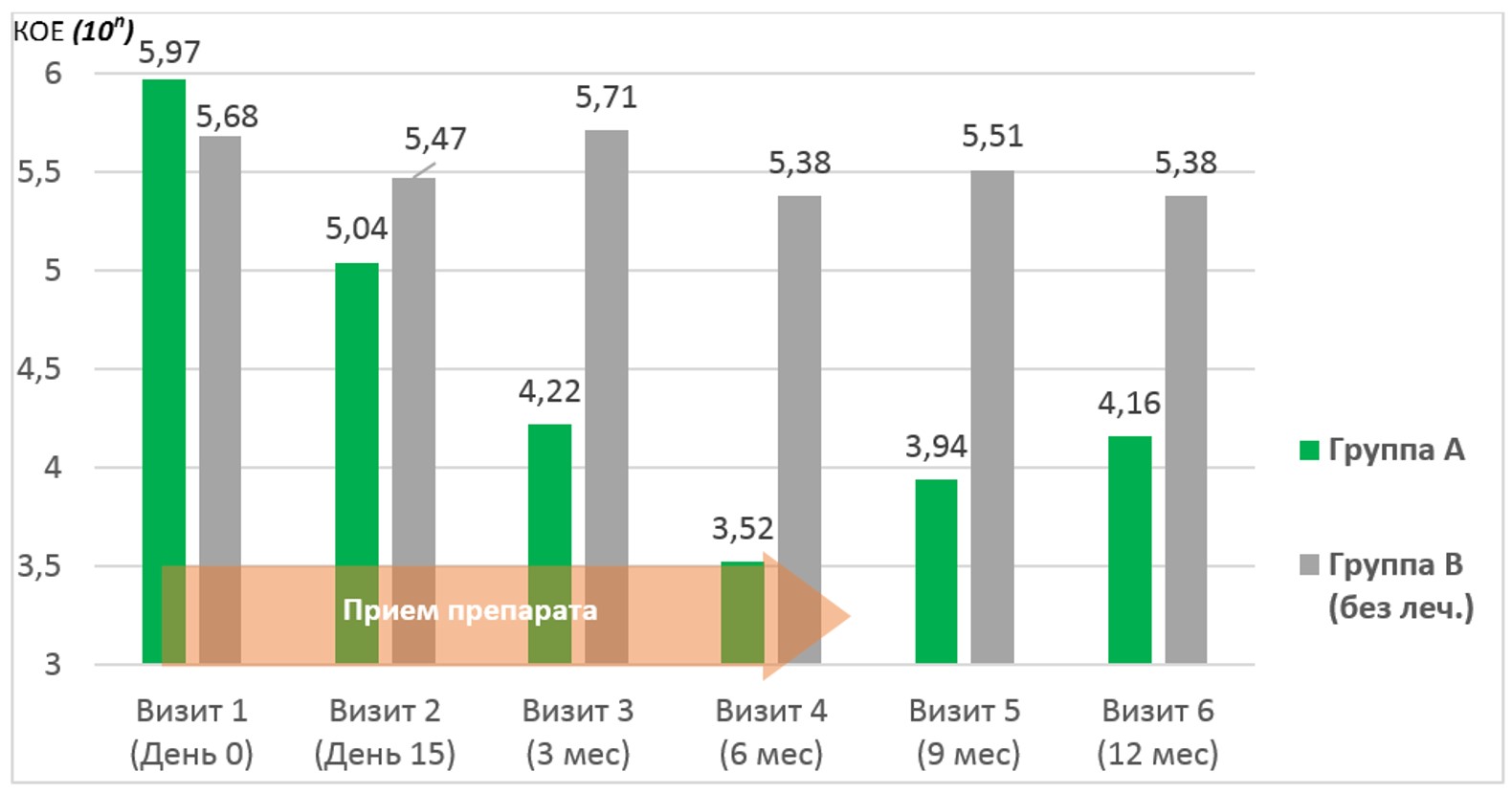
Статистически достоверное, клинически значимое и стойкое снижение полиморфизма уропатогенов существенно более ярко проявилось у больных группы А – на 60,4%, до 0,87 патогена в течение 6 месяцев с дальнейшей регрессией показателя по окончанию проспективного периода наблюдения до 1,33 патогена (ΔM=39.5%). У группы сравнения статистически достоверных изменений не выявлено.
Детальный анализ динамики отдельных уропатогенов по принципу «эрадикация/титр≤103», показал статистически достоверную редукцию клинически значимых микроорганизмов среди больных клинической группы А в отношении E.Coli на 61,1%, Klebsiella pneumonia - на 33,1%, P.Mirabilis - на 19,1%, P.Aeruginosa - на 21,1%, Candida spp.- на 19,4%.
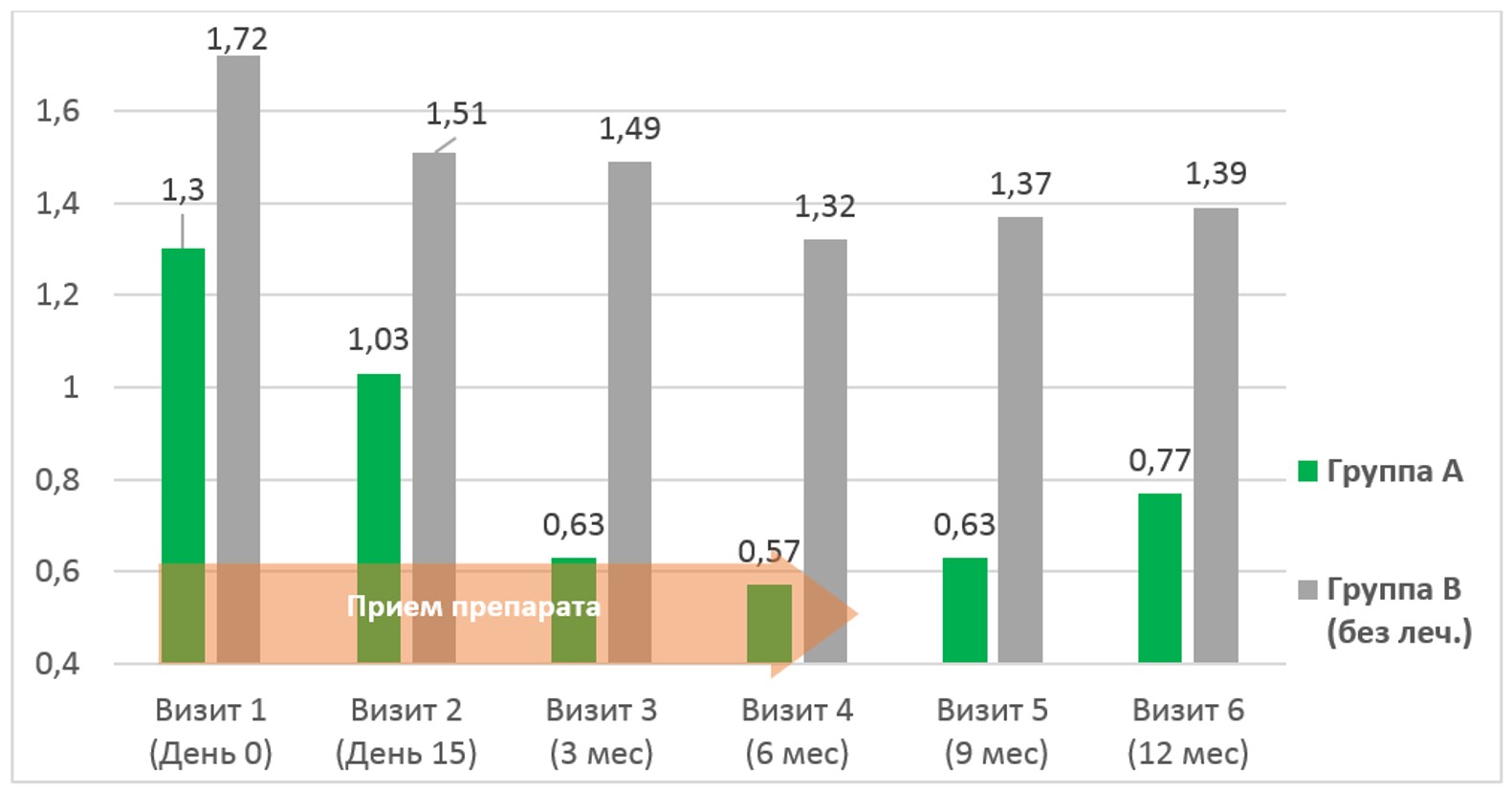
Клиническую эффективность лечения, помимо прямого опроса и сбора жалоб, мы оценивали опросником UTISA. В основном, изменения клинических симптомов находились в корреляционной зависимости относительно лабораторной динамики пиурии и бактериурии. Следует отметить высокую эффективность снижения частоты мочеиспусканий среди больных клинической группы А – на 48,3% в течении 6 месяцев (см. рис.4), в последующем периоде наблюдения суммарная эффективность лечения была так же статистически выше среди больных группы А (ΔM=40,8%).
Рис.4. Оценка динамики частоты мочеиспусканий по UTISA на протяжении исследования (баллы)
Интегральный показатель выраженности симптомов UTISA, характеризующий, помимо вышеуказанных жалоб, проявления урогенитальной боли, продемонстрировал существенный приоритет эффективности лечения, получаемого пациентками группы А (ΔM=24,7% против 6,5% у группы сравнения В) по окончанию активной фазы исследования. Динамика результатов группы сравнения на протяжении всего исследования статистически значимой не была.
Аналогичные результаты получены нами при оценке динамики влияния клинических симптомов на качество жизни больных по UTISA на протяжении исследования. Клиническая группа продемонстрировали позитивный эффект приема исследуемого препарата на качество жизни пациентов с достоверно более высокими результатами: динамика показателя в течение периода приема препарата составила 54,6%.
Достоверная лабораторная и клиническая эффективность лечения исследуемым препаратом нашла непосредственное отражение в домене общего здоровья SF-36. Позитивный эффект приема Цисто-Аурина у больных основной клинической группы показал эффективность устранения ключевых нарушений общего состояния здоровья в процессе лечения на протяжении 6 месяцев на 111,3%. Соответствующие изменения группы сравнения В статистически достоверными не были.
Данные домена энергичности SF-36 у больных основной клинической группы также продемонстрировали сходную картину – повышение показателя жизненной активности через 6 месяцев приема препарата в группе А на 37,1%. Достоверных отличий между показателями в группе сравнения В выявлено не было.
Присущее часто-рецидивирующим ИМП снижение социальной активности и дезадаптация больных под бременем длительного течения заболевания, в процессе лечения подверглись существенному улучшению. Так, показатели домена социальной активности SF-36 на протяжении исследования охарактеризовались существенными позитивными изменениями в группе А: оптимизация социальных функций и увеличение активности в течение 6 месяцев составили 39,6%.
Статистически-достоверные изменения домена физического здоровья SF-36 выявлены в динамике лечения только среди пациенток группы А по окончанию шести месяцев приема препарата (ΔM=19%, р=0,04).
В домене ментального здоровья, отражающем совокупность характеристик социальной адаптации, жизненных сил, компенсаторных возможностей и копинг-поведения пациенток (снижение качества жизни и компенсаторные изменений личности, которые позволяют женщине с рецидивирующим циститом адаптироваться к социуму: туалетная картография, постоянное ограничение приема жидкости, ношение темной одежды и т.д.), существенный приоритет отмечен в результатах лечения больных группы А – динамика в течении 6 месяцев составила 33,4%. Полные данные основых результатов исследования представлены в Таблице 2.
Табл.2. Итоговые данные основных результатов исследования, где указаны следующие группы пациентов: А – лечение по 1 табл. 4 раза в день, В – без лечения.
|
|
Группы пациентов |
Визит 1 (День 0) |
Визит 2 (День 15) |
Визит 3 (3 мес.) |
Визит 4 (6 мес.) |
Визит 5 (9 мес.) |
Визит 6 (12 мес.) |
|
Число рецидивных эпизодов ИМПт (за предыдущие 3 месяца) |
А |
13 |
- |
4 |
1 |
5 |
5 |
|
В |
14 |
- |
11 |
13 |
10 |
11 |
|
|
Бактериурия у исследуемых больных, КОЕ (10n) |
А |
5,97 |
5,04 |
4,22 |
3,52 |
3,94 |
4,16 |
|
В |
5,68 |
5,47 |
5,71 |
5,38 |
5,51 |
5,38 |
|
|
Число уропатогенов в культуральном исследовании мочи |
А |
2,2 |
1,8 |
0,93 |
0,87 |
1,1 |
1,33 |
|
В |
2,06 |
2,02 |
1,87 |
1,89 |
1,91 |
1,77 |
|
|
Частота мочеиспусканий по UTISA, баллы |
А |
1,3 |
1,03 |
0,63 |
0,57 |
0,63 |
0,77 |
|
В |
1,72 |
1,51 |
1,49 |
1,32 |
1,37 |
1,39 |
|
|
Показатель ургентности, баллы |
А |
1,17 |
0,97 |
0,57 |
0,47 |
0,63 |
0,77 |
|
В |
1,28 |
1,21 |
1,16 |
1,18 |
1,19 |
1,17 |
|
|
Выраженность боли/жжения UTISA, баллы |
А |
0,47 |
0,43 |
0,23 |
0,27 |
0,27 |
0,3 |
|
В |
0,51 |
0,54 |
0,47 |
0,51 |
0,49 |
0,47 |
|
|
Влияние симптомов на качество жизни по UTISA, баллы |
А |
6,17 |
5,6 |
3,03 |
2,8 |
3,4 |
4,07 |
|
В |
6,4 |
6,32 |
6,17 |
6,21 |
6,23 |
6,18 |
Резюме
Нами проведено исследование клинической и лабораторной эффективности, а также влияния на качество жизни интермиттирующей терапии препаратом золотарника обыкновенного – Цисто-аурин у больных с часто-рецидивирующей ИМП. Получены объективные данные, свидетельствующие о достоверном снижении числа рецидивов ИМП на 92,3% в течение 6 месяцев лечения препаратом (группа А, 1 таб. 4 р/день). Анализ влияния препарата на лабораторные проявления часто-рецидивирующей инфекции мочевой системы показал позитивный эффект терапии в отношении пиурии, редукцию провоспалительной активности и статистически-достоверное уменьшение проявления воспаления в мочевой системе. Редукция лейкоцитурии у больных, принимающих препарат, составила 73,4% (т.е. в 3,7 раза ниже исходных значений).
Дискретная и количественная оценка влияния на бактериурию показала клинически значимый и статистически достоверный бактериостатический эффект, выраженный как в процессе лечения препаратом (на 41,0%), так и в проспективном 6-месячном периоде наблюдения после (на 30,3%). Антибактериальный эффект в отношении клинически-значимых уропатогенов подтвердил редукцию штаммов E.Coli на 61,1%, Klebsiella pneumonia на 33,1%, P.Mirabilis на 19,1%, P.Aeruginosa на 21,1%, Candida spp. на 19,4%.
Симптоматика рекуррентного хронического цистита показала достоверное снижение выраженности ключевых клинических симптомокомплексов рецидивной ИМП: поллакиурии (на 48,3%), императивных позывов (59,8%), боли и жжения (42,6%), неполного опорожнения мочевого пузыря (53,8%).
Динамика показателей качества жизни, связанного со здоровьем SF-36, на фоне приема препарата продемонстрировала статистически значимую индукцию ключевых доменов качества жизни больных часто-рецидивирующими ИМП: психического здоровья (33,4%) и общего качества жизни (19,6%).
Выводы
- Часто-рецидивирующие ИМП – источник драматических нарушений всех сфер социальной, трудовой, семейной и сексуальной жизни женщин наиболее трудоспособного, социально-активного и репродуктивно-значимого возраста, нарушающие все сферы жизни индивидуума, приводящие к дезадаптации, ограничениям в повседневной активности, социальных и личных контактах и ведущие к социальной изоляции, а иногда и инвалидизации пациентки.
- Цисто-аурин – эффективное и безопасное средство лечения больных с часто-рецидивирующей ИМП, позволяющее при интермиттирующем приеме (15 дней каждого месяца) существенно сократить частоту рецидивов патологии, объективно уменьшить количественные и качественные проявления бактериурии и пиурии. Прием препарата сопровождается объективным уменьшением частоты мочеиспусканий и ургентных позывов, снижением боли и дискомфорта. Результатом приема препарата является улучшение социальной адаптации, взаимоотношений с близкими, самооценки больных, возврат пациента в привычное социальное окружение и ритм повседневной активности, общее улучшение качества жизни, связанного со здоровьем.
- Терапия препаратом Цисто-аурин – действенная и безопасная альтернатива пролонгированной антибиотикопрофилактике часто-рецидивирующей ИМП с отсутствием модуляции популяционной антибиотикорезистентности, индукции фунгинальной активности и дисбиотических проявлений при долговременном приеме.
- Статистическая оценка результатов применения Цисто-аурина, определила клиническую и лабораторную эффективность, сопоставимую с долговременной антибиотикопрофилактикой препаратами группы нитрофуранов. В дальнейшем целесообразно продолжить исследование эффективности препарата золотарника 300 мг в сопоставлении с препаратом из группы традиционной продолжительной антибактериальной профилактики рецидивных ИМП - фосфомицином.
Литература:
- Flores-Mireles, Ana L. et al. “Urinary Tract Infections: Epidemiology, Mechanisms of Infection and Treatment Options.” Nature reviews. Microbiology13.5 (2015): 269–284. PMC. Web. 9 Jan. 2018.
- Schappert SM, Rechtsteiner EA. Ambulatory medical care utilization estimates for 2007. Vital Health Stat. 2011;13:1–38.
- T.L. Griebling. Urologic diseases in America project: trends in resource use for urinary tract infections in women. J Urol, 173 (2005), pp. 1281-1287
- Grabe M, Bartoletti R, Bjerklund-Johansen TE et al. European Association of Urology: Guidelines on Urological Infections. 2015
- S. Dason, J.T. Dason, A. Kapoor. Guidelines for the diagnosis and management of recurrent urinary tract infection in women. Can Urol Assoc J, 5 (2011), pp. 316-322
- C.L. Grimes, E.S. Lukacz. Urinary tract infections. Female Pelvic Med Reconstr Surg, 17 (2011), pp. 272-278.
- Matthew Glover, Cristiano G. Moreira, Vanessa Sperandio, Philippe Zimmern, Recurrent urinary tract infections in healthy and nonpregnant women, Urological Science, Volume 25, Issue 1, 2014, Pages 1-8
- W.E. van der Starre, C. van Nieuwkoop, S. Paltansing, J.W. van't Wout, G.H. Groeneveld, M.J. Becker, et al. Risk factors for fluoroquinolone-resistant Escherichia coli in adults with community-onset febrile urinary tract infection. J Antimicrob Chemother, 66 (2011), pp. 650-656
- Foxman B. Urinary tract infection syndromes: occurrence, recurrence, bacteriology, risk factors, and disease burden. Infect Dis Clin North Am. 2014;28:1–13.
- K. Ejrnæs. Bacterial characteristics of importance for recurrent urinary tract infections caused by Escherichia coli. Dan Med Bull, 58 (2011), p. B4187
- P.L. Dwyer, M. O'Reilly. Recurrent urinary tract infection in the female. Curr Opin Obstet Gynecol, 14 (2002), pp. 537-543
- B. Foxman, R. Barlow, H. D'Arcy, B. Gillespie, J.D. Sobel. Urinary tract infection: self-reported incidence and associated costs. Ann Epidemiol, 10 (2000), pp. 509-515
- European Goldenrod // Herbal Medicines. —4th edition. — 2013. — 928 p.
- Assessment report on Solidago virgaurea L. herba // European Medicines Agency. — 2008.
- Melzig MF. Goldenrod--a classical exponent in the urological phytotherapy. Wien Med Wochenschr. 2004 Nov;154(21-22):523-7.
- Kołodziej B., Kowalski K., Kędzia B. Antibacterial and antimutagenic activity of extracts aboveground parts of three Solidago species: Solidago virgaurea L., Solidago canadensis L. and Solidago gigantea Ait. // Journal of Medicinal Plants Research. — 2011. — V. 5, № 31. — P. 6770-6779.
- L Laurençon, E Sarrazin, M Chevalier, I Prêcheur, G Herbette, X Fernandez. Triterpenoid saponins from the aerial parts of Solidago virgaurea alpestris with inhibiting activity of Candida albicans yeast-hyphal conversion. Phytochemistry, Volume 86, 2013, pp. 103-111
- Courtney M. Starks, Russell B. Williams, Matt G.Goering, Mark O’Neil-Johnson, Vanessa L. Norman, Jin-Feng Hu, Eliane Garo, Grayson W. Hough, Stephanie M.Rice, Gary R. Eldridge. Antibacterial clerodane diterpenes from Goldenrod (Solidago virgaurea). Phytochemistry, Volume 71, Issue 1, 2010, pp. 104-109
- Y Deng, Y Zhao, O Padilla-Zakour, G Yang. Polyphenols, antioxidant and antimicrobial activities of leaf and bark extracts of Solidago canadensis L. Industrial Crops and Products, Volume 74, 2015, pp. 803-809
- Brantner A. The antimicrobial activity of Solidago-containing phytourologica // Drogen-report. — 1999. — V. 12. — P. 27-28.
- Thiem B., Goślińska O. Antimicrobial activity of Solidago virgaurea L. from in vitro cultures // Fitoterapia. — 2002. — V. 73, № 6. — P. 514-516.
- Strehl E., Schneider W., Elstner E.F. Inhibition of dihydrofolate reductase activity by alcoholic extracts from Fraxinus excelsior, Populus tremula and Solidago virgaurea // Arzneimittelforschung. — 1995. — V. 45, № 2. — P. 172-173.
- Kalemba D. Constituents and biological activity of the essential oils of some Solidago and Artemisia species // Scientific Papers Technical University of Lodz. — 2000. — V. 857. — P. 1-118
- Pepeljnjak S., Kustrak D., Vukusic I. Investigation of the antimycotic activity of Solidago virgaurea and Solidago gigantea extracts // Pharm. Pharmacol. Lett. — 1998. — V. 8. — P. 85-86.
- Triterpenoid saponins from the aerial parts of Solidago virgaurea alpestris with inhibiting activity of Candida albicans yeasthyphal conversion / Laurençon L., Sarrazin E., Chevalier M. et al. // Phytochemistry. — 2013. — V. 86. — P. 103-111.
- Echtes Goldenrutenkraut als entzündungshemmende Droge / Melzig M.F., Löser B., Bader G., Papsdorf G. // Z. Phytother. — 2000. — V. 21. — P. 67-70.
- Meyer B., Schneider W., Elstner E.F. Antioxidative properties of alcoholic extracts from Fraxinus excelsior, Populus tremula and Solidago virgaurea // Arzneimittelforschung. — 1995. — V. 45, № 2. — P. 174-176.
- Immunomodulatory and antitumoral effects of triterpenoid saponins / Plohmann B., Bader G.T., Hiller K., Franz G. // Pharmazie. — 1997. — V. 12. — P. 953-957.
- Immunmodulatorische und antitumorale Aktivität von Triterpensaponinen aus Solidago virgaurea L. / Plohmann B., Franz G., Bader G., Hiller K. // Drogenreport. — 1999. — V. 12. — P. 29-30.
- Immunobiological activity of a new benzyl benzoate from the aerial part sof Solidago virgaurea var. gigantea / Choi S.Z., Choi S.U., Bae S.Y. et al. // Arch. Pharm. Res. — 2005. — V. 28. — P. 49-54.
- Westendorf J., Vahlensieck W. Spasmolytische und kontraktile Einflüsse eines pflanzlichen Kombinations-präparates auf die glatte Muskulatur des isolierten Meerschweinchendarms // ArzneimForsch/Drug Res. — 1981. — V. 31. — P. 40-43. Extracts from Rhois aromatica and Solidaginis virgaurea inhibit rat and human bladder contraction / Borchert V.E., Czyborra P., Fetscher C. et al. // Naunyn Schmiedebergs Arch. Pharmacol. — 2004. — V. 369, № 3. — P. 281-286.
- Metzner J., Hirschelmann R., Hiller K. Antiphlogistische und analgetische Wirkungen von Leiocarposid, einem phenolischen Bisglucosid aus Solidago virgaurea L. // Pharmazie. — 1984. — V. 39. — P. 869-870.
- Ethnomedicinally selected plants as sources of potential analgesic compounds: indication of in vitro biological activity in receptor binding assays / Sampson J.H., Phillipson J.D., Bowery N.G. et al. // Phytother Res. — 2000. — V. 14, № 1. — P. 24-9.
- Melzig, M.F. New aspects for understanding the mechanism of the aquaretic effects of birch leaves and goldenrod // Zeitschrift fur Phytotherapie. — 2000. — V. 21, № 4. — P. 193-196.
- Brantner A. The antimicrobial activity of Solidago-containing phytourologica // Drogen-report. — 1999. — V. 12. — P. 27-28.
- Thiem B., Goślińska O. Antimicrobial activity of Solidago virgaurea L. from in vitro cultures // Fitoterapia. — 2002. — V. 73, № 6. — P. 514-516.
- Strehl E., Schneider W., Elstner E.F. Inhibition of dihydrofolate reductase activity by alcoholic extracts from Fraxinus excelsior, Populus tremula and Solidago virgaurea // Arzneimittelforschung. — 1995. — V. 45, № 2. — P. 172-173.
- Schakau D. Solidago Steiner® Tabletten. Solidago Steiner® Lösung und Harntee Steiner® // Portfolio-Schulung. — Januar, 2014.
- Frumenzio E. at al. Role of phytotherapy associated with antibiotic prophylaxis in female patients with recurrent urinary tract infections. Archivio Italiano di Urologia e Andrologia 2013; 85, 4.
Подготовили Шостак М.В., Костев Ф.И., Лукинюк Е.И.
Опубліковано в журналі «Український медичний часопис» №4(1) (126) – VII/VIII'2018


