За матеріалами конференції «Актуальні питання сучасної діабетології» (11-13 квітня, 2019)
Автор: П. Кемплер, професор, Університет Земмельвейс, м. Будапешт, Угорщина
Відомо, що вагомими факторами ризику кардіоваскулярних захворювань у пацієнтів із цукровим діабетом (ЦД) є соматична та автономна дисфункції [2]. Нейропатія виявилася найсильнішим незалежним ризиком підвищення смертності пацієнта. Для зниження ризику серцево-судинних ускладнень у пацієнтів із ЦД слід ретельно підходити до діагностики діабетичної нейропатії (ДН) та застосовувати для терапії ефективні препарати з достатньою доказовою базою та високим профілем безпеки. Стратегія лікування має бути максимально виваженою. Найбільш перспективним препаратом для патогенетичної терапії ДН є альфа-ліпоева (тіоктова) кислота (АЛК) , роль якої в оптимізації ведення пацієнтів із ЦД варто обговорити докладніше.
Пряма кореляція між ДН і серцево-судинним ризиком наразі не викликає сумнівів. Показові та цікаві результати були нещодавно отримані Lasse Bjerg та співавт. (2019) у ході проспективного дослідження (n=3828), в якому вчені оцінювали вплив мікроваскулярних порушень на показники смертності.
Дослідники використовували такі діагностичні критерії:
- нефропатія – швидкість клубочкової фільтрації (ШКФ) <60 мл/хв і рівень співвідношення альбумін /креатинін сечі >3,5 г/ммоль або мікроальбумінурія;
- нейропатія – патологічні результати біотензіометрії.
Результати показали, що нейропатія та нефропатія суттєво підвищують рівень смертності у хворих на ЦД [3]. Патогенетичні механізми такого зв’язку між ДН та рівнем смертності у хворих на ЦД на сьогодні добре вивчені. Відомими є й особливості клінічної картини ДН, що можуть виникати в пацієнтів із ЦД. Так, симптоми ДН наразі поділяються на 2 основні групи:
- Позитивні: постійний пекучий або ниючий біль; пароксизмальний стріляючий колючий біль; дисестезії (болісні парестезії); оніміння, підвищена реакція на больове подразнення – гіпералгезія, сприйняття небольового подразнення як больового – алодинія.
- Негативні: гіпоалгезія, аналгезія; гіпоестезія, анестезія; зниження теплової, вібраційної, тактильної чутливості та рефлексів.
! Позитивні симптоми, як можна пересвідчитися, пов’язані з болем, що змушує пацієнта звертатися за допомогою до лікаря. Небезпека негативних симптомів полягає в тому, що вони нібито не завдають хворому відчутного дискомфорту. Проте нейропатія, яка супроводжується зниженням чутливості, стає причиною формування «німих» виразок та діабетичної стопи (табл. 1) [4, 5].
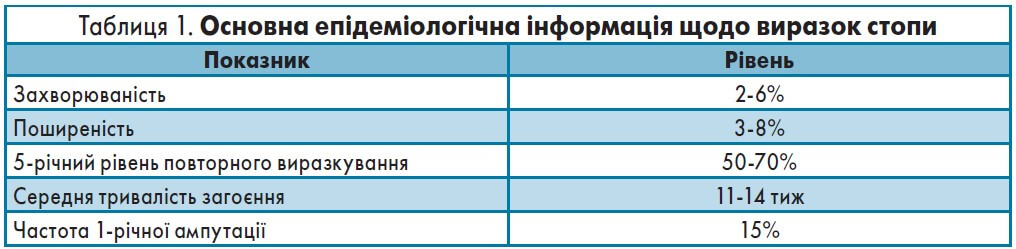
Це ускладнення не просто погіршує якість життя пацієнтів, воно стає причиною втрати працездатності та інвалідності: кожні 30 с у світі через діабет один хворий втрачає нижню кінцівку [6].
Ще одним фактором, який впливає на смертність пацієнтів із ЦД, є автономна нейропатія (АН). Метааналіз низки проспективних досліджень показав, що загальний рівень 10-річної смертності в пацієнтів із симптомами кардіальної АН дорівнював 29%, тоді як у пацієнтів без цих симптомів він становив лише 6% [7].
Фактори, асоційовані з підвищенням ризику смертності в пацієнтів з АН:
- Подовження інтервалу QT. У дослідженні Kempler та співавт. тривалість інтервалу QT зростала прямо пропорційно ступеню тяжкості АН у пацієнтів із ЦД 1 типу [8].
- Ранні шлуночкові екстрасистоли.
- Шлуночкова тахікардія. АН є основною причиною тахікардії в пацієнтів із ЦД за умови виключення гіпертиреозу, анемії та інфекцій.
- Фібриляція шлуночків.
- Раптова смерть. Взаємозв’язок між ступенем тяжкості АН та частотою раптової кардіоваскулярної смерті був підтверджений у метааналізі Zaccardi та співавт. [9].
Знижена чутливість при АН часто стає причиною виникнення безбольової форми інфаркту міокарда у хворих на ЦД. Цей діагноз потрібно запідозрити за наявності будь-якого з таких симптомів: гостра серцева недостатність або набряк легень; колапс; блювання; кетоацидоз або гіперглікемія невстановленої етіології.
Ще одним кардіоваскулярним проявом АН є артеріальна гіпертензія (АГ). Дослідження I. Istenes та співавт. показало, що серцево-судинна АН є незалежним фактором, асоційованим з АГ у хворих на ЦД 2 типу та нормоальбумінурію, які не страждали на АГ до цього. Усі пацієнти з нормотензією та симптомами АН мають проходити скринінг на АГ із використанням амбулаторного моніторингу артеріального тиску (АТ) для раннього початку лікування та покращання прогнозу [10].
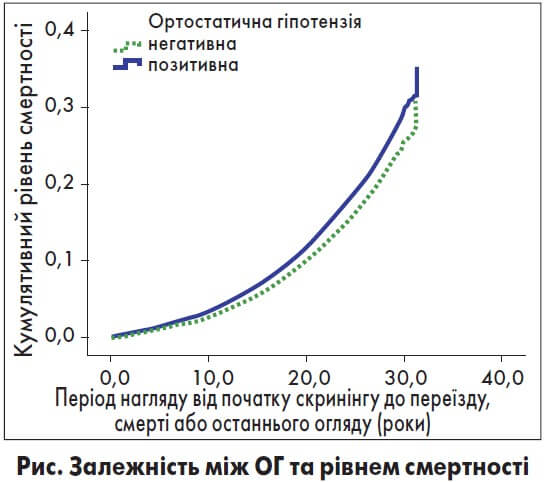
Крім АГ у пацієнтів з АН може розвинутися ортостатична гіпотензія (ОГ), симптоми якої часто інтерпретують як гіпоглікемію. Залежність між ОГ та рівнем смертності досліджували Fedorowski та співавт. (рис.) [11].
Таким чином, наявність ОГ підвищує смертність і ризик коронарних подій незалежно від інших факторів ризику.
Незважаючи на те що ДН підвищує ризик смерті в пацієнтів із ЦД, її часто не діагностують своєчасно [12]. Діагностика сенсорних та автономних нейропатій має включати збір скарг та фізикальний огляд із використанням спеціальних методик і тестів (табл. 2).
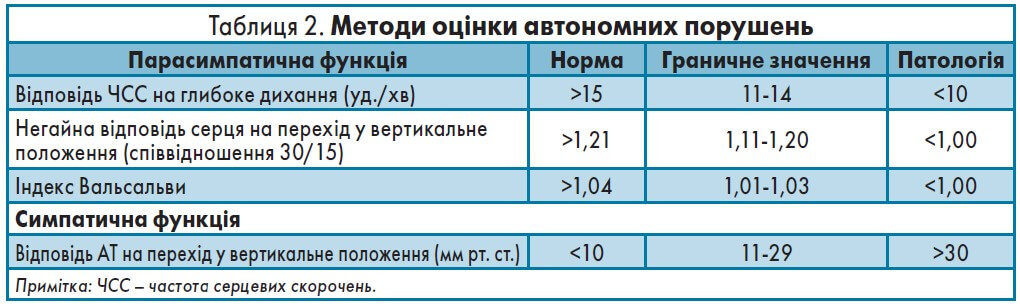
Методи оцінки сенсорних порушень:
- Камертон Ріделя-Сейфера (Rydel-Seiffer).
- Монофіламент Семмес-Вейнштейна (Semmes-Weinstein).
- Нейрометр (поріг сприйняття струму).
- Нейродіагностична медична система «Medoc» (поріг сприйняття вібрації, холоду та тепла).
! Лікування нейропатій має покращувати прогноз завдяки впливу на патогенез захворювання, та підвищувати якість життя пацієнтів, впливаючи на симптоми. Метою патогенетичної терапії є гальмування, зупинка або навіть зворотний розвиток прогресування нейропатії і, як наслідок, зменшення симптомів.
Основні напрями патогенетичної терапії:
- Оптимальний глікемічний контроль (пероральні цукрознижувальні засоби, інсулін).
- Вплив на фактори ризику (відмова від паління, антигіпертензивні препарати, статини, ацетилсаліцилова кислота).
- Бенфотіамін.
- АЛК.
В основі патогенезу всіх ускладнень ЦД лежить єдиний механізм. Гіперглікемія підвищує продукцію вільного радикалу кисню супероксиду та реактивних видів кисню, які з них утворюються. Супероксиди активують головні шляхи гіперглікемічного пошкодження, знижуючи активність ключового ферменту гліколізу гліцеральдегід‑3-фосфат дегідрогенази (GAPDH).
Одним із найбільш перспективних антиоксидантних препаратів для лікування нейропатії в пацієнтів із ЦД є АЛК. Її ефективність і сприятливий профіль безпеки підтверджені в результаті низки клінічних досліджень високої якості.
Так, у рандомізованому паралельному подвійному сліпому дослідженні (Ziegler D., Nowak H., Kempler P. еt al., 2004) метаболічно стабільні пацієнти з ЦД та симптоматичною діабетичною сенсомоторною полінейропатією отримували АЛК (600 мг) або плацебо щодня внутрішньовенно протягом 14 днів. Первинними кінцевими точками була зміна підсумкової оцінки за загальною шкалою неврологічних симптомів (Total Symptom Score – TSS). Вторинними кінцевими точками були підсумкові бали за шкалою ознак нейропатії; оцінці симптомів, що відображають нервову провідність; кількісному тесті чутливості та вегетативному тесті. Після 14 днів оцінка за TSS у групі прийому АЛК достовірно покращала в порівнянні з вихідними показниками в середньому на 5,7 пункту, а в групі плацебо – лише на 1,8 пункту (p<0,001). Дослідження підтвердило ефективність і безпеку АЛК у лікуванні діабетичних нейропатій [14].
Підтвердження високої ефективності АЛК зібрані в метааналізі чотирьох контрольованих клінічних досліджень (ALADIN I, ALADIN III, SYDNEY, NATHAN II) за участю 1258 пацієнтів із ЦД. Отримані результати свідчать, що лікування АЛК 600 мг/день протягом 3 тижнів достовірно зменшує вираженість як позитивних, так і негативних симптомів нейропатії та є безпечним для пацієнтів із ЦД та симптоматичною полінейропатією [15].
Papanas і співавт. (2014) у своїй роботі зазначають, що АЛК, в порівнянні з аналгетичними препаратами, що досить часто вживають при больовій формі ДН, має більш швидкий початок дії, зменшує вираженість нейропатичного болю, парестезій, оніміння, сенсорних дефіцитів і покращує м’язову силу. Крім цього, АЛК значно краще переноситься хворими. Автори також зазначають, що призначення АЛК є особливо актуальним у пацієнтів із коморбідною патологією або за наявності серцево-судинної вегетативної нейропатії [16].
Ефективність АЛК (800 мг/добу протягом 4 міс) у зменшенні симптомів кардіальної АН у пацієнтів із ЦД, які не отримують інсулін, була підтверджена в дослідженні Ziegler і співавт. [17]. Крім того, у низці досліджень продемонстрована доцільність комбінованого застосування АЛК із бенфотіаміном для профілактики і лікування серцево-судинних захворювань, зокрема кардіоваскулярної АН у хворих на ЦД.
Довідка ЗУ
На вітчизняному фармацевтичному ринку АЛК упродовж багатьох років представлена препаратом ЕСПА-ЛІПОН® виробництва «Еспарма ГмбХ» (Німеччина) – це антиоксидантний лікарський засіб, який зменшує вираженість окислювальних процесів, а отже, безпосередньо впливає на патогенез діабетичних ускладнень, ефективність і безпека якого підтверджені тривалим застосуванням у клінічній практиці. Загальноприйнята схема терапії ДПН препаратом ЕСПА-ЛІПОН®, як і для інших препаратів АЛК: 600 мг/добу парентерально
10-20 днів із наступним переходом на пероральний прийом 600 мг/добу протягом 1-2 місяців. Оскільки ДПН – хронічне захворювання, то й терапія має бути тривалою та регулярною.
Різноманітні форми випуску (розчин для ін’єкцій і таблетки) дають можливість використовувати ЕСПА-ЛІПОН® не лише в умовах стаціонару, але й амбулаторно, що підвищує комплаєнс пацієнтів до терапії. У разі неможливості розпочати лікування з парентерального введення оптимальним рішенням буде почати терапію з перорального прийому 1800 мг/добу протягом 10-20 днів, ураховуючи біодоступність таблеток, з подальшим переходом на пероральний прийом 600 мг/добу до завершення курсу лікування (1-2 міс у залежності від стану тяжкості хворого).
ЕСПА-ЛІПОН® – універсальний антиоксидант, органопротектор і детоксикант із доведеним терапевтичним ефектом і високим профілем безпеки – є важливою і невід’ємною ланкою лікування пацієнтів із ДПН. Отже, ЕСПА-ЛІПОН® запобігає прогресуванню кардіоваскулярних ускладнень і значно покращує якість життя пацієнтів та прогноз перебігу ЦД.
Підготувала Ганна Кирпач
Опубліковано в тематичному номері «Діабетологія, Тиреоїдологія, Метаболічні розлади» №2(46)'2019


