Кількість пацієнтів із COVID-19 експоненційно збільшується в усьому світі внаслідок високої трансмісивності вірусу SARS-CoV-2. Перші надії на зниження смертності при COVID-19 шляхом застосування деяких «переорієнтованих» препаратів (ремдесивіру, гідроксихлорохіну, лопінавіру/ритонавіру, інтерферону) завершилися поразкою (WHO Solidarity Trial Consortium, 2020). Тому увагу спеціалістів привертають плюрипотентні препарати, що мають відомий позитивний ефект при лікуванні пневмонії, хронічного обструктивного захворювання легень (ХОЗЛ), респіраторного дистрес-синдрому, інших запальних процесів у дихальних шляхах мікробного, токсичного та імунологічного генезу.
4 переваги «переорієнтованих» ліків
Пошук серед відомих препаратів тих, застосування яких, імовірно, може забезпечувати хороший результат при COVID-19, має перевагу в аспекті збереження часу порівняно з розробленням нових препаратів. Останніх зараз налічується близько 400, в тому числі >30 біологічних (Cadegiani F.A., 2020). Відомо мінімум чотири основні переваги добре вивчених препаратів: 1) відомий профіль безпеки, що забезпечує вибіркове призначення і цілеспрямований моніторинг побічних реакцій; 2) можливість прогнозувати клінічні ефекти; 3) клініцистам добре відомі дозування; 4) препарати давно перебувають на ринку, мають порівняно невисоку ціну. Одним із таких потенційно перспективних лікарських засобів є ацетилцистеїн.
Деякі аспекти клінічного перебігу COVID-19
SARS-CoV-2 — одноланцюговий РНК-вірус сферичної форми (діаметр — 60–200 нм), зазвичай має чотири різновиди глікопротеїнів шипів — типу S, E, M і N (Ferreira A.O. et al., 2020). На сьогодні відомо три рецептори екзопептидази коронавірусів у клітинах людини: АПФ 2-го типу, амінопептидаза N та дипептидилпептидаза-4 (DPP4). Експресія DPP4 обернено пропорційна параметрам функції легень, що може частково пояснити той факт, що жителі екологічно забруднених районів і пацієнти з хронічним обструктивним захворюванням легень (ХОЗЛ) більш сприйнятливі до COVID-19.
Реплікація вірусу всередині клітини людини здійснюється РНК-залежною РНК-полімеразою, а щойно сформовані віріони вивільняються із клітини-господаря шляхом екзоцитозу. Клітини респіраторного епітелію, розміщені в дихальних шляхах (носова порожнина, гортань, бронхи, бронхіоли і альвеоли), є кращими клітинами-господарями вірусу SARS-CoV-2 (Rockx B. et al., 2020). Втім, рецептор АПФ 2-го типу також виявлений у різних позалегеневих тканинах, включаючи серце, нирки і кишківник, що може пояснити ураження цих органів при COVID-19 (Zhang H. et al., 2020a). У дітей і людей молодого віку зазвичай легший перебіг, що, можливо, пов’язане з нижчою експресією рецептора АПФ 2-го типу (Yuki K. et al., 2020). Крім того, стать і гормональна забезпеченість також можуть впливати на експресію АПФ 2-го типу: його рівні вищі у чоловіків ніж у жінок, що може частково пояснювати вищий ступінь тяжкості та смертність серед пацієнтів-чоловіків (Patel S.K. et al., 2020; Yuki K. et al., 2020).
З урахуванням характерного наростання тяжкості стану, відмінних клінічних проявів і ефекту від лікування розрізняють три основні фази клінічного перебігу COVID-19 (Siddiqi H.K., Mehra M.R., 2020) (рис. 1).
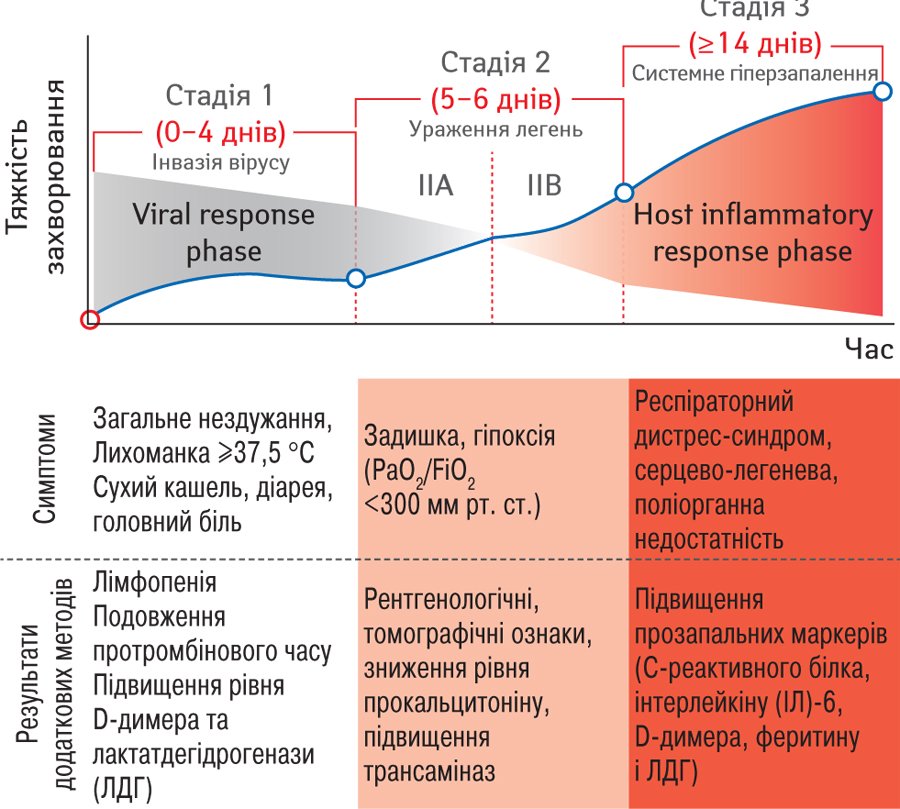
Рис. 1. Клініко-патогенетичні стадії COVID-19 (Siddiqi H.K., Mehra M.R., 2020)
Одужання може настати як на 1-й, так і на 2-й стадії, але за несприятливого розвитку подій запальний процес різко наростає і набуває системного характеру (рис. 2). На цій стадії підвищується рівень запальних біомаркерів (наприклад ІЛ-2, -6, -7, фактора некрозу пухлини-α, С-реактивного білка, феритину і D-димера. Зменшується кількість хелперних, супресорних, регуляторних, CD4+ і CD8+ Т-лімфоцитів. Фактично зниження функціонального різноманіття Т-клітин у периферичній крові може передбачити тяжке прогресування у пацієнтів із COVID-19 (Diao B. et al., 2020). Імовірно, цитокіновий шторм при інфекції SARS-CoV-2 є результатом пригніченої імунної відповіді, посиленого запалення і надмірного окисного стресу (Tufan A. et al., 2020).
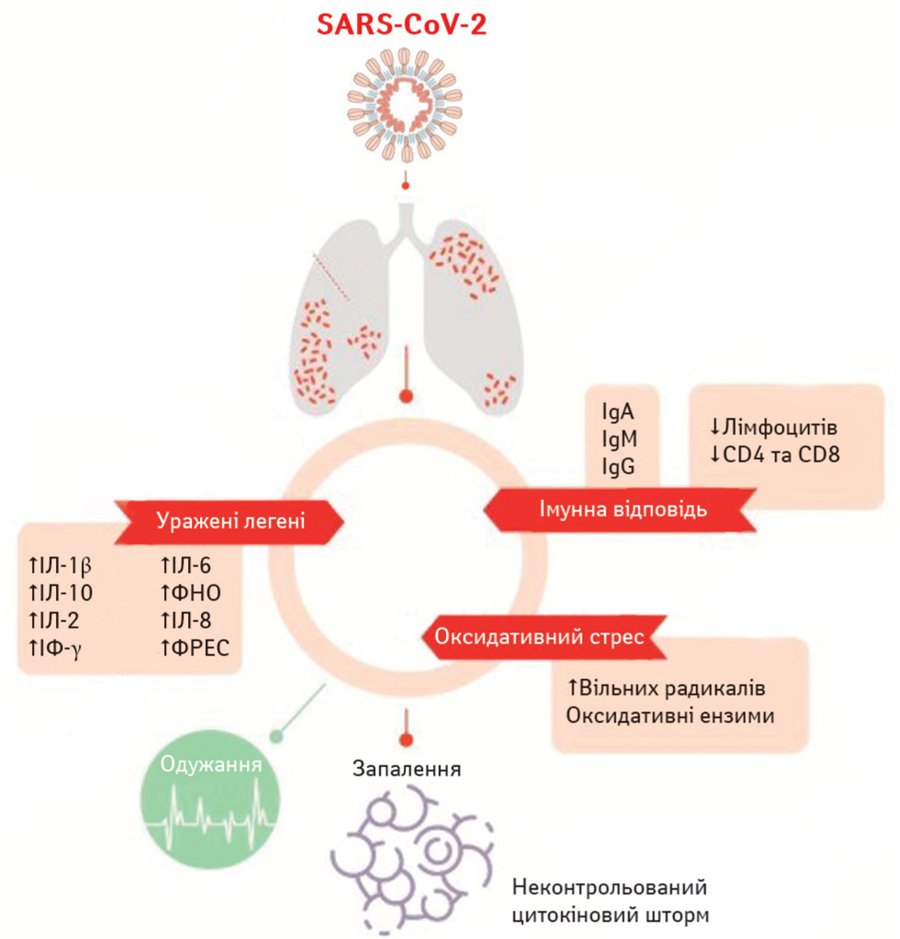
Рис. 2. Патофізіологічні механізми ураження легень при інфекції SARS-CoV-2 (Ferreira A.O. 2020; Zhang R. et al., 2020b).
ІФ — інтерферон; ФРЕС — фактор росту ендотелію судин
Плейотропні ефекти ацетилцистеїну: муколітик, пневмопротектор, антиоксидант
Перш за все, ацетилцистеїн — це муколітик прямої дії, здатний розріджувати густе та гнійне мокротиння (рис. 3). В експериментах іn vitro продемонстровано, що тіольні (сульфгідрильні) групи ацетилцистеїну, гідролізуючи дисульфідні зв’язки, знижують в’язкість і еластичність гелевої фази слизу та розріджують його без суттєвого збільшення обсягу.
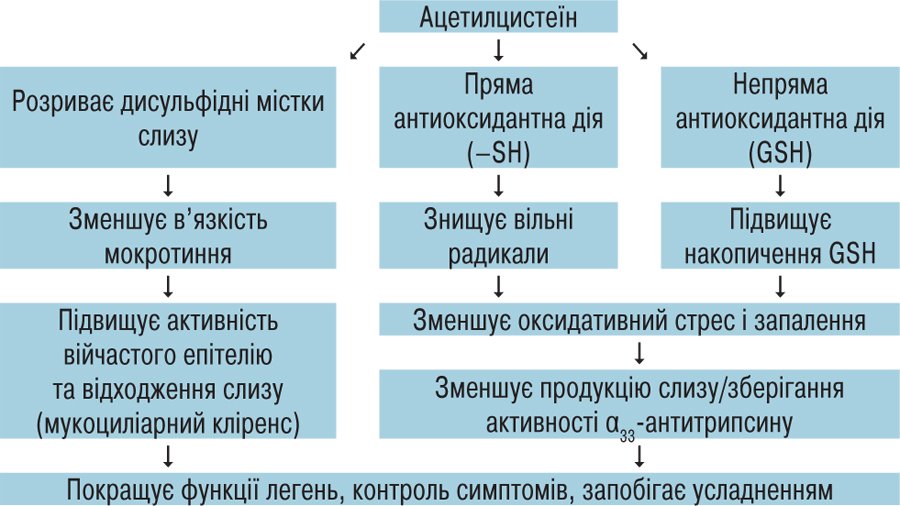
Рис. 3. Мукоактивні й антиоксидантні властивості ацетилцистеїну (Yan X. et al., 2017)
Здатність запобігати апоптозу покладена в основу пневмопротекторних властивостей ацетилцистеїну. Продемонстрована його спроможність уповільнювати деструкцію легеневої тканини та розвиток емфіземи легень за рахунок зниження активності еластази та мієлопероксидази, впливу на продукцію лактоферину, забезпечення захисту антипротеазних ферментів (зокрема α1-антитрипсину) від вільнорадикального окиснення, зниження хемоатрактантної активності нейтрофілів (Eklund A. et al., 1988).
Ацетилцистеїн — попередник глутатіону, що діє як потужний антиоксидант, нейтралізатор вільних радикалів в організмі та мукоактивний агент (рис. 3) (Aldini G. et al., 2018). Наявний великий досвід застосування препарату при широкому спектрі патологій верхніх і нижніх дихальних шляхів (Pei Y. et al., 2018). Його використовують у лікуванні пацієнтів із респіраторним дистрес-синдромом з метою зменшення або запобігання ураженню легень, а також (у дуже високих дозах) — у разі гострого отруєння парацетамолом (Zhang Y. et al., 2017). Також відзначено хорошу переносимість тривалої терапії препаратом у високих дозах.
Завдяки хорошій переносимості та плейотропним ефектам ацетилцистеїн може бути застосований як лікувально-профілактичний засіб при різних захворюваннях, що включають виснаження системи глутатіону і окисний стрес. Припускають, що ацетилцистеїн може знизити ризик тяжкого перебігу COVID-19, подібно до грипу та інших гострих респіраторних захворювань. Більше того, можна очікувати, що високі дози ацетилцистеїну відіграватимуть ад’ювантну роль у лікуванні у разі тяжких випадків COVID-19, запобігаючи небажаним явищам з боку легень і серцево-судинної системи (De Flora S. et al., 2020).
Запобігання проникненню вірусів
Рецепторзв’язувальний домен білків шипів вірусу SARS-CoV-2 має кілька залишків цистеїну. Молекулярно-динамічне моделювання показало, що афінність зв’язування була значно порушена, коли всі дисульфідні зв’язки рецепторів АПФ 2-го типу і шипів SARS-CoV-2 були відновлені до тіолових груп. Продемонстрована клінічна здатність ацетилцистеїну блокувати рецептори АПФ 2-го типу (Boesgaard S. et al., 1993) може забезпечити захист від проникнення вірусу в клітину, а також шкідливого впливу ангіотензину II при інфекції SARS-CoV-2. Так, in vitro показано, що ацетилцистеїн дозозалежним чином зменшує зв’язування ангіотензину II з рецептором ангіотензину II 1-го типу (Ullian M.E. et al., 2005). У контексті COVID-19 ацетилцистеїн може блокувати надмірне вироблення ангіотензину, зменшуючи тяжкість ураження легень (Tang N. et al., 2020).
Ацетилцистеїн допомагає запобігати і контролювати вірусні інфекції шляхом посилення функцій тол-подібних рецепторів (toll-like receptors 7) і мітохондріального антивірусного сигнального білка (mitochondrial antiviral-signaling protein — MAVS) у процесі стимулювання продукції інтерферону 1-го типу (McCarty M.F., DiNicolantonio J.J., 2020). Інтерферони, у свою чергу, також можуть пригнічувати реплікацію вірусу SARS.
Ослаблення окисного стресу
Окисний стрес і запалення строго взаємопов’язані. Вплив на клітини гідроксильного радикала (•OH) або супероксид-радикального аніона (O2•–) викликає дозозалежне вивільнення прозапальних цитокінів, і цей процес посилюється за рахунок виснаження ресурсу відновленого глутатіону (De Flora S. et al., 2020). Зазначимо, що останній не лише впливає на певні фактори, які беруть участь в імунологічних процесах, але також змінює складні імунні реакції, такі як лихоманка, і є дані, що припускають, що індукція лихоманки пов’язана з окисним стресом (Cugno M. et al., 2020). Будучи джерелом глутатіону, ацетилцистеїн знайшов застосування для ослаблення токсичності різних агентів, що викликають утворення вільних радикалів, а також для терапії і/або профілактики різних захворювань, пов’язаних із виснаженням глутатіону і змінами окисно-відновного статусу, таких як серцеві захворювання, цукровий діабет, ВІЛ-інфекція, нейродегенеративні захворювання, нервово-психічні розлади і ряд інших станів (Liu M. et al., 1998; Arranz L. et al., 2008; De Flora S. et al., 2017).
Деякі основні механізми, відповідальні за антиоксидантні/протизапальні властивості ацетилцистеїну, представлені на рис. 4. Перш за все, давно встановлено, що ацетилцистеїн є потужним поглиначем вільних радикалів (Aruoma O.I. et al., 1989). Інгібування ацетилцистеїном судинних Н-оксидаз має відношення до профілактики артеріальної гіпертензії та патологічних станів, пов’язаних із неконтрольованим зростанням і запаленням, таких як атеросклероз (Griendling K.K. et al., 2000). Ацетилцистеїн підсилює судинорозширювальну і антиагрегаційну дію оксиду азоту, що дуже корисно в контексті гострої серцевої недостатності, гострої ішемії та інфаркту міокарда (Loscalzo J. et al., 2001).
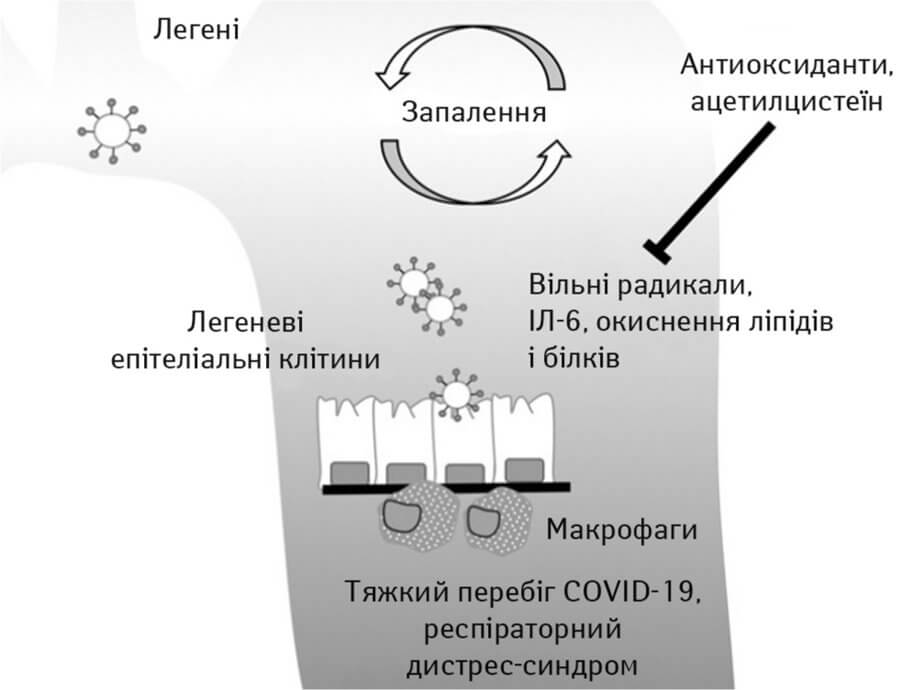
Рис. 4. Антиоксидантні властивості ацетилцистеїну (Nasi A., et al., 2020)
Перешкоджання інактивації α1-антитрипсину і здатність знижувати рівні ІЛ-8 і С-реактивного білка ведуть до поліпшення клінічних результатів у пацієнтів із загостреннями ХОЗЛ, зокрема за наявності бронхоектазів, за даними рандомізованого контрольованого дослідження (Zuin R. et al., 2005; Qi Q. et al., 2019).
Ацетилцистеїн також знижує внутрішньоклітинну концентрацію перекису водню і відновлює внутрішньоклітинний загальний вміст тіолів шляхом пригнічення транслокації NFκB в ядро клітини і фосфорилювання кінази MAP3K14 (Hui D.S.C., Lee N., 2013). При грипозній інфекції ацетилцистеїн пригнічує індукцію прозапальних цитокінів шляхом активації NFκB, викликаної ендосомним тол-подібним рецептором (Lai K.Y. et al., 2015).
Зменшення вираженості запалення
Ацетилцистеїн володіє протизапальною активністю, про що свідчить перешкоджання вивільненню ІЛ-6 і вірус-опосередкованої цитотоксичності (рис. 5) (Calzetta L. et al., 2018). У багатоцентровому рандомізованому плацебо-контрольованому дослідженні, що триває, вивчають раннє введення ацетилцистеїну з подальшим пероральним прийомом раміприлу протягом 12 тиж з метою оцінки впливу цієї стратегії на функцію серця, якість життя і маркери запалення у пацієнтів із рідкісним спадковим захворюванням (Ong G.J. et al., 2020).
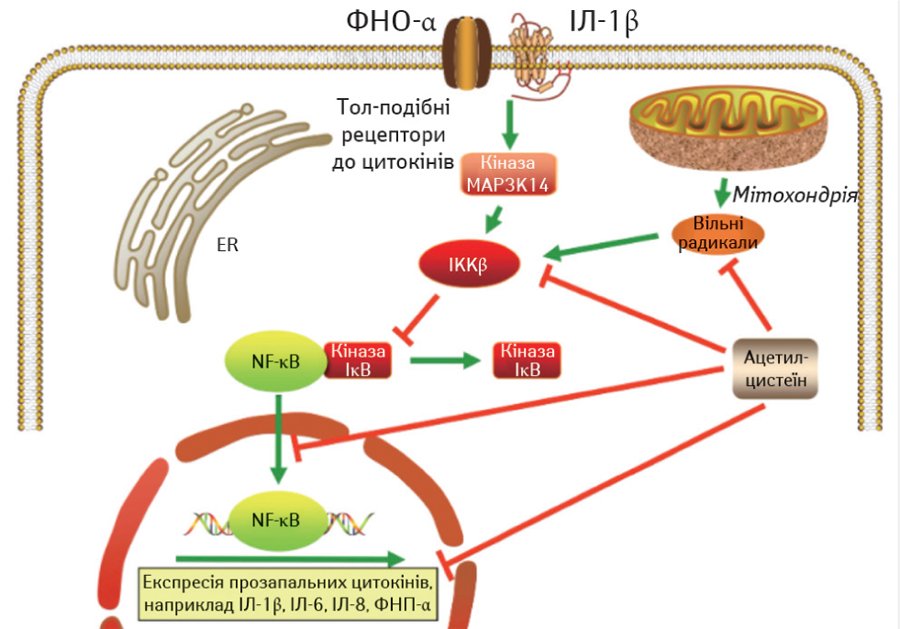
Рис. 5. Протизапальні властивості ацетилцистеїну (кіназа MAP3K14 — мітоген-активована протеїнових потрійна кіназа-14); IKKβ — інгібітор бета-субодиниці кінази ядерного фактора; NF-κB — універсальний транскрипційний фактор) (Pei Y. et al., 2018)
В експериментальних тестових моделях ацетилцистеїн продемонстрував здатність модулювати велику кількість пов’язаних з курінням і онкопатологією кінцевих точок завдяки безлічі взаємопов’язаних механізмів і властивостей (De Flora S. et al., 2001; Balansky R. et al., 2010). Крім того, в рандомізованому подвійному сліпому плацебо-контрольованому дослідженні II фази показано, що ацетилцистеїн знижує концентрацію біомаркерів запалення у завзятих курців, які отримували препарат у пероральній формі (600 мг) 2 рази на добу протягом 6 міс (van Schooten F.J. et al., 2002).
Ацетилцистеїн при грипі та гострих респіраторних захворюваннях
За даними досліджень, ацетилцистеїн знижує частоту і зменшує тяжкість грипу та грипоподібних захворювань. Він протестований у подвійному сліпому дослідженні за участю 20 італійських центрів, в якому взяли участь 262 суб’єкти обох статей, відібраних випадковим шляхом для перорального прийому плацебо або ацетилцистеїну (600 мг) 2 рази на добу протягом 6 міс. Як місцеві, так і системні симптоми гострих респіраторних захворювань, були статистично значущою мірою менш вираженими і рідкісними у пацієнтів, які застосовували препарат. Більше того, тільки у 25% інфікованих вірусом грипу A/H1N1 суб’єктів, які отримували лікування, розвинулася симптоматична форма порівняно із 79% у групі плацебо (De Flora S. et al., 1997).
Інфекція РНК-вірусами викликає окисний стрес у клітинах-господарях, і все більше даних свідчать про те, що реплікація вірусу регулюється окисно-відновним станом організму із залученням глутатіону (Nencioni L. et al., 2003). Експериментальне дослідження показало, що ацетилцистеїн зменшує реплікацію вірусу грипу у клітинах ниркового і дихального епітелію, знижує титр вірусу як в легенях, так і в трахеї (Cai J. et al., 2003). Також продемонстровано, що ацетилцистеїн інгібує реплікацію вірусу й експресію прозапальних молекул у клітинах альвеолярного епітелію людини, інфікованих високопатогенним вірусом грипу H5N1 (Geiler J. et al., 2005). Результати досліджень in vivo дозволяють припустити, що ацетилцистеїн сприяє противірусній дії рибавірину та озельтамівіру (Ho W.Z. et al., 1992; Ghezzi P., Ungheri D., 2004).
Лікування у разі патології легень
Рандомізоване подвійне сліпе плацебо-контрольоване проспективне клінічне дослідження, проведене у 5 відділеннях інтенсивної терапії в США і Канаді, показало, що внутрішньовенне введення ацетилцистеїну (70 мг/кг маси тіла) кожні 8 год протягом 10 днів ефективно поповнювало запаси глутатіону в організмі зі зменшенням тривалості гострого ураження легень і поліпшенням функції серця (Bernard G.R. et al., 1997). В іншому дослідженні пацієнти, госпіталізовані у відділення інтенсивної терапії, які отримували ацетилцистеїн (150 мг/кг у 1-й день, потім — 50 мг/кг протягом 3 днів), мали кращий клінічний результат порівняно із пацієнтами групи плацебо (Soltan-Sharifi M.S. et al., 2007).
Ацетилцистеїн застосовують також для профілактики ШВЛ-пневмонії (Sharafkhah M. et al., 2018). У рандомізованому подвійному сліпому плацебо-контрольованому дослідженні за участю 60 пацієнтів, які отримували щодня через назогастральний зонд 1200 мг ацетилцистеїну, з меншою ймовірністю розвивалася пневмонія, тривалість перебування у лікарні та відділенні інтенсивної терапії була коротшою. Крім того, частота повного одужання була вищою у групі ацетилцистеїну.
Вивчено також здатність ацетилцистеїну долати антибактеріальну резистентність грампозитивних і грамнегативних мікроорганізмів, руйнуючи біоплівки, що перешкоджають впливу антибіотика на популяцію мікробів (Domenech M., García E., 2017). Формування стійкості за рахунок біоплівок ймовірне у разі багатьох хронічних захворювань дихальних шляхів, а також у результаті інвазивних медичних процедур (установка катетерів, ендотрахеальних трубок, зондів тощо) (Lebeaux D. et al., 2014).
Висновки
Застосування ацетилцистеїну як ад’ювантної терапії у пацієнтів із легкими або тяжкими симптомами COVID-19 варто вважати економічно ефективною клінічною стратегією (Poe F.L., Corn J., 2020; Rangel-Méndez J.-A., Moo-Puc R.-E., 2020). Її доцільність підтримана хорошими результатами застосування ацетилцистеїну у лікуванні пацієнтів із ХОЗЛ, грипом і ШВЛ-асоційованою пневмонією. Зараз проводиться декілька клінічних випробувань, які оцінюють потенційне застосування ацетилцистеїну при COVID-19. Наприклад, клінічне випробування «The COVID-19 HOPE Clinical Trial» за участю пацієнтів, які перебувають на ШВЛ (Quay S., 2020). Інше дослідження — «A Study of N-acetylcysteine in Patients With COVID-19 Infection» — спрямоване на кількісну оцінку сприятливих результатів лікування (Memorial Sloan Kettering Cancer Center, 2020).
Попередній досвід клінічного застосування і результати досліджень дозволяють припустити, що і у разі легкого перебігу захворювання застосування ацетилцистеїну може сприятливо позначатися на стані здоров’я пацієнтів. Особи похилого віку, курці, пацієнти із ХОЗЛ, цукровим діабетом, іншими хронічними захворюваннями та інтоксикацією, що супроводжуються запаленням і порушенням окисно-відновного балансу, можуть приймати препарат при перших ознаках респіраторного захворювання або для профілактики.
Пероральне застосування ацетилцистеїну (600 мг/добу) може також діяти як профілактичний захід, особливо у тих, хто неоднократно піддавався впливу можливих носіїв SARS-CoV-2 (наприклад медичні працівники).
На фармацевтичному ринку України ацетилцистеїн представлений декількома препаратами. Призначаючи ацетилцистеїн, лікарю варто звернути увагу на ЕВКАБАЛ® САШЕ 200 мг і 600 мг від німецької компанії «esparma GmbH». Серед інших муколітиків ЕВКАБАЛ® САШЕ відрізняє висока якість сировини і дуже конкурентна ціна.
Список використаної літератури
- Aldini G., Altomare A., Baron G. et al.(2018) N-acetylcysteine as an antioxidant and disulphide breaking agent: the reasons why. Free Radic. Res., 52(7): 751–762.
- Arranz L., Fernandez C., Rodriguez A. et al.(2008) The glutathione precursor N‐acetylcysteine improves immune function in postmenopausal women. Free Radic. Biol. Med., 45: 1252–1262.
- Aruoma O.I., Halliwell B., Hoey B.M., Butler J.(1989) The antioxidant action of N‐acetylcysteine: its reaction with hydrogen peroxide, hydroxyl radical, superoxide, and hypochlorous acid. Free Radic. Biol. Med., 6: 593–597.
- Balansky R., Ganchev G., Iltcheva M. et al.(2010) Prevention of cigarette smoke‐induced lung tumors in mice by budesonide, phenethyl isothiocyanate and N‐acetylcysteine. Int. J. Cancer, 126: 1047–1054.
- Bernard G.R., Wheeler A.P., Arons M.M. et al.(1997) A trial of antioxidants N‐acetylcysteine and procysteine in ARDS. The Antioxidant in ARDS Study Group. Chest, 112: 164–172.
- Boesgaard S., Aldershvile J., Poulsen H.E. et al.(1993) N-acetylcysteine inhibits angiotensin converting enzyme in vivo. J. Pharmacol. Exp. Ther., 265(3): 1239–1244.
- Cadegiani F.A.(2020) Repurposing existing drugs for COVID-19: an endocrinology perspective. BMC Endocr. Disord., 20: 149.
- Cai J., Chen Y., Seth S. et al.(2003) Inhibition of influenza infection by glutathione. Free Radic. Biol. Med., 34: 928–936.
- Calzetta L., Matera M.G., Rogliani P., Cazzola M.(2018) Multifaceted activity of N‐acetyl‐l‐cysteine in chronic obstructive pulmonary disease. Expert. Rev. Respir. Med., 12: 693–708.
- Cugno M., Meroni P.L., Gualtierotti R. et al.(2020) Complement activation in patients with COVID‐19: A novel therapeutic target. J. Allergy Clin. Immunol., 14: S0091–S6749(20)30650‐3.
- De Flora S., Balansky R., La Maestra S.(2020) Rationale for the use of N-acetylcysteine in both prevention and adjuvant therapy of COVID-19. FASEB J. doi: 10.1096/fj.202001807.
- De Flora S., Grassi C., Carati L.(1997) Attenuation of influenza‐like symptomatology and improvement of cell‐mediated immunity with long‐term N‐acetylcysteine treatment. Eur. Respir. J., 10: 1535–1541.
- De Flora S., Izzotti A., D’Agostini F. et al.(2001) Mechanisms of N‐acetylcysteine in the prevention of DNA damage and cancer, with special reference to smoking‐related end‐points. Carcinogenesis, 22: 999–1013.
- Diao B., Wang C., Tan Y. et al.(2020) Reduction and Functional Exhaustion of T Cells in Patients With Coronavirus Disease 2019 (COVID-19) Front. Immunol., 11: 827.
- Domenech M., García E.(2017) N-Acetyl-l-Cysteine and Cysteamine as New Strategies against Mixed Biofilms of Nonencapsulated Streptococcus pneumoniae and Nontypeable Haemophilus influenza. Antimicrob. Agents Chemother., 61(2): e01992–16. DOI: 10.1128/AAC.01992-16.
- Eklund A., Eriksson O., Håkansson L. et al.(1988) Oral N-acetylcysteine reduces selected humoral markers of inflammatory cell activity in BAL fluid from healthy smokers: correlation to effects on cellular variables. Eur. Respir. J., 1(9): 832–838.
- Ferreira A.O., Polonini H.C., Dijkers E.C.F.(2020) Postulated Adjuvant Therapeutic Strategies for COVID-19. J. Pers. Med., 10(3): 80.
- Geiler J., Michaelis M., Naczk P. et al.(2010) N‐acetyl‐L‐cysteine (NAC) inhibits virus replication and expression of pro‐inflammatory molecules in A549 cells infected with highly pathogenic H5N1 influenza A virus. Bioch Pharmacol., 79: 413–420.
- Ghezzi P., Ungheri D.(2004) Synergistic combination of N‐acetylcysteine and ribavirin to protect from lethal influenza viral infection in a mouse model. Int. J. Immunopathol. Pharmacol., 17: 99–102.
- Griendling K.K., Sorescu D., Ushio‐Fukai M.(2000) NAD(P)H oxidase: role in cardiovascular biology and disease. Circ. Res., 86: 494–501. 10.1161/01.res.86.5.494.
- Ho W.Z., Douglas S.D.(1992) Glutathione and N‐acetylcysteine suppression of human immunodeficiency virus replication in human monocyte/macrophages in vitro. AIDS Res. Hum. Retroviruses., 8: 1249–1253.
- Horowitz R.I., Freeman P.R.(2020) Three novel prevention, diagnostic, and treatment options for COVID-19 urgently necessitating controlled randomized trials. Med. Hypotheses, 143: 109851.
- Hui D.S.C., Lee N.(2013) Adjunctive therapies and immunomodulating agents for severe influenza. Influenza Other. Respir. Viruses., 7(Suppl. 3): 52–59.
- Lai K.Y., Wing Yiu G.N.G., Cheng F.F.(2015) The W‐shaped mortality‐age distribution of novel H1N1 influenza virus helps reconstruct the second wave of pandemic 1918 Spanish flu. J Pulm Respir Med., 5: 245.
- Lebeaux D., Ghigo J.-M., Beloin C.(2014) Biofilm-Related Infections: Bridging the Gap between Clinical Management and Fundamental Aspects of Recalcitrance toward Antibiotics. Microbiology and Molecular Biology Reviews, American Society for Microbiology, 78(3): pp. 510–543.
- Liu M., Pelling J.C., Ju J. et al.(1998) Antioxidant action via p53‐mediated apoptosis. Cancer Res., 58: 1723–1729.
- Loscalzo J.(2001) Nitric oxide insufficiency, platelet activation, and arterial thrombosis. Circ Res., 88: 756–762.
- McCarty M.F., DiNicolantonio J.J.(2020) Nutraceuticals Have Potential for Boosting the Type 1 Interferon Response to RNA Viruses Including Influenza and Coronavirus. Prog. Cardiovasc. Dis., 63(3): 383–385.
- Memorial Sloan Kettering Cancer Center(2020) A study of N-acetylcysteine in patients with COVID-19 infection (https://clinicaltrials.gov/ct2/show/NCT04374461).
- Nasi A., McArdle S., Gaudernack G., Westman G., Melief C., et al.(2020) Reactive oxygen species as an initiator of toxic innate immune responses in retort to SARS-CoV-2 in an ageing population, consider N-acetylcysteine as early therapeutic intervention. Toxicology Reports, ISSN: 2214-7500, Vol: 7, Page: 768-771.
- Nencioni L., Iuvara A., Aquilano K. et al.(2003) Influenza A virus replication is dependent on an antioxidant pathway that involves GSH and Bcl‐2. FASEB J., 17: 758–760.
- Ong G.J., Nguyen T.H., Stansborough J. et al.(2020) The N‐AcetylCysteine and RAMipril in Takotsubo Syndrome Trial (NACRAM): Rationale and design of a randomised controlled trial of sequential N‐Acetylcysteine and ramipril for the management of Takotsubo Syndrome. Contemp. Clin. Trials, 90: 105894.
- Patel S.K., Velkoska E., Burrell L.M.(2020) Emerging markers in cardiovascular disease: Where does angiotensin-converting enzyme 2 fit in? Clin. Exp. Pharmacol. Physiol., 40: 551–559.
- Pei Y., Liu H., Yang Y. et al.(2018) Biological Activities and Potential Oral Applications of N-Acetylcysteine: Progress and Prospects. Oxid. Med. Cell Longev., 2018: 2835787.
- Poe F.L., Corn J.(2020) N-Acetylcysteine: A potential therapeutic agent for SARS-CoV-2. Medical Hypotheses, 143: 109862.
- Qi Q., Ailiyaer Y., Liu R. et al.(2019) Effect of N‐acetylcysteine on exacerbations of bronchiectasis (BENE): a randomized controlled trial. Respir. Res., 20: 73.
- Quay S.(2020) COVID-19 treatment HOPE protocol (https://drquay.com/covid-19-doctor/).
- Rangel-Méndez J.-A., Moo-Puc R.-E.(2020) N-acetylcysteine as a potential treatment for COVID-19. Fut. Microbiol., 15: 959–962.
- Rockx B., Kuiken T., Herfst S. et al.(2020) Comparative pathogenesis of COVID-19, MERS, and SARS in a nonhuman primate model. Science, 368: 1012–1015.
- Sharafkhah M., Abdolrazaghnejad A., Zarinfar N. et al.(2018)Safety and efficacy of N-acetyl-cysteine for prophylaxis of ventilator-associated pneumonia: a randomized, double blind, placebo-controlled clinical trial. Med. Gas. Res., 8: pp. 19–23.
- Siddiqi H.K., Mehra M.R.(2020) COVID-19 Illness in Native and Immunosuppressed States: A Clinical-Therapeutic Staging Proposal. J. Hear. Lung Transplant., 39: 405.
- Soltan‐Sharifi M.S., Mojtahedzadeh M., Najafi A. et al.(2007) Improvement by N‐acetylcysteine of acute respiratory distress syndrome through increasing intracellular glutathione, and extracellular thiol molecules and anti‐oxidant power: evidence for underlying toxicological mechanisms. Human Exp. Toxicol., 26: 697–703.
- Tang N., Bai H., Chen X. et al.(2020) Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. J. Thromb. Haemost., 18: 1094–1099.
- Tufan A., Avanoğlu Güler A., Matucci-Cerinic M.(2020) Covid-19, immune system response, hyperinflammation and repurposinantirheumatic drugs. Turk. J. Med. Sci., 50: 620–632.
- Ullian M.E., Gelasco A.K., Fitzgibbon W.R. et al.(2005) N-acetylcysteine decreases angiotensin II receptor binding in vascular smooth muscle cells. J. Am. Soc. Nephrol., 16(8): 2346–2353.
- Van Schooten F.J., Besaratinia A., De Flora S. et al.(2002) Effects of oral administration of N‐acetyl‐L‐cysteine: a multi‐biomarker study in smokers. Cancer Epidemiol. Biom. Prev., 11: 167–175.
- Yan X., Song Y., Shen C. et al.(2017) Mucoactive and antioxidant medicines for COPD: consensus of a group of Chinese pulmonary physicians. Int. J. Chron. Obstruct. Pulmon. Dis., 12: 803–812.
- Yuki K., Fujiogi M., Koutsogiannaki S.(2020) COVID-19 pathophysiology: A review. Clin. Immunol., 215: 108427.
- Zhang H., Penninger J.M., Li Y. et al.(2020a) Angiotensin-converting enzyme 2 (ACE2) as a SARS-CoV-2 receptor: Molecular mechanisms and potential therapeutic target. Intensive Care Med., 46: 586–590.
- Zhang R., Wang X., Ni L. et al.(2020b) COVID-19: Melatonin as a potential adjuvant treatment Rui. Life Sci., 250: 117583.
- Zhang Y., Ding S., Li C. et al.(2017) Effects of N-acetylcysteine treatment in acute respiratory distress syndrome: A meta-analysis. Exp. Ther. Med., 14(4): 2863–2868.
- Zuin R., Palamidese A., Negrin R. et al.(2005) High‐dose N‐acetylcysteine in patients with exacerbations of chronic obstructive pulmonary disease. Clin. Drug Invest., 25: 401–408.
Підготувала Полякова Дар’я
Опубліковано в журналі «Український медичний часопис» №5(139), Т.1-IX/X'2020


